Este documento presenta información sobre los biocatalizadores, en particular las enzimas. Explica las propiedades y características de las enzimas, incluyendo su estructura, especificidad, mecanismos de acción y tipos de reacciones catalizadas. También describe los modelos de unión enzima-sustrato y los pasos de las reacciones enzimáticas, así como los factores que afectan la velocidad de las reacciones catalizadas por enzimas.


















![ENZIMAS : PROPIEDADES
Proteicas:
solubilidad, desnaturalización, PI, etc.
Especificidad
De Reacción: para cada tipo de reacción química, incluso realizada por un mismo
sustrato, existe una enzima diferente (una enzima cataliza una sola reacción
química o un grupo de reacciones estrechamente relacionadas)
De Sustrato: Sobre un tipo de sustrato
Absoluta (sólo actúan sobre un tipo de sustrato)
Relativa (reconocen el grupo funcional)
EA EB EC
Reversibilidad: A B C P
Eficacia: ↓[ ] (las necesidades enzimáticas son muy bajas y cantidades mínimas de
enzima pueden transformar grandes cantidades de sustrato)
Catalizadores: no se consumen en el trascurso de las reacciones, la misma molécula
puede actuar repetidamente.
Recuperación: se alteran y se destruyen con el tiempo, por lo que se deben de renovar
de forma periódica.](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-20-320.jpg)










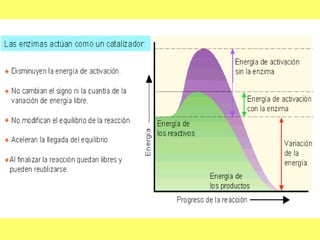
![Las reacciones bioquímicas se inicia con la
rotura de los enlaces entre los átomos de
las moléculas de los reactivos, para formar
nuevos enlaces que originan las moléculas
de los productos.
Estado de transición o estado activado:
estado en que los reactivos están debilitados o
rotos, pero en los que aún no se han formado
los nuevos
Velocidad de reacción: V =[ P ] / t
FACTORES:
Tª (no en seres vivos ⇐ s.
Isotérmicos)
Presencia de catalizadores: ↓ la E. de
activación (es la energía necesaria
para que los reactivos se
transformen en productos para
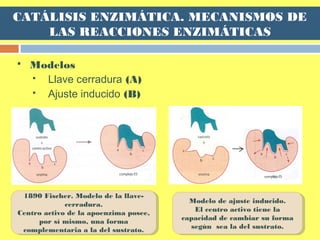
CATÁLISIS ENZIMÁTICA. MECANISMOS DE
LAS REACCIONES ENZIMÁTICAS
Sustrato (reactivo) =>
Producto](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-32-320.jpg)


![ENZIMAS: CINÉTICA ENZIMÁTICA
Al aumentar la [S] =>
aumenta la velocidad de la
reacción. (mientras existe
enzima libre)
Cuando la [E ]se satura por
la [S] => la velocidad se
mantiene constante y es
máxima.
V máxima => Kd = [E][S]/
[ES]
(Para calcular la Kd , se
tiene que conocer la [S] y
[ES], valores que no se
pueden establecer
directamente. Cuando la
velocidad de la reacción es
Velocidad: V =[ P ]/ t
Gráfica Hipérbola
rectangular
1 U ≡ µmol S/min ≡ µmol
P/min](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-35-320.jpg)
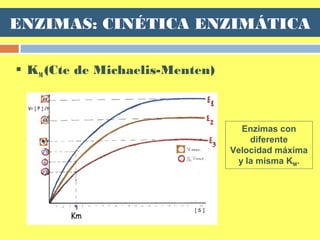
![ KM (Cte de Michaelis-Menten): [S] con la que la
reacción alcanza la mitad de la Vmáx .
Afinidad por el S (especificidad): ↑ KM ⇒ ↓
Afinidad
ENZIMAS: CINÉTICA ENZIMÁTICA](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-36-320.jpg)
![ KM (Cte de Michaelis-Menten)
Afinidad por el S (especificidad): ↑ KM ⇒ ↓ Afinidad
[ ]
[ ]SK
SV
V
m
o
+
⋅
= max
KM = K2 + K3
K1
⇒
ENZIMAS: CINÉTICA ENZIMÁTICA](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-37-320.jpg)
![Tomando los inversos en los dos miembros de la ecuación =>
Ecuación de Lineweaver-Burk modificaron la fórmula de la Vo aplicando los
valores inversos, la gráfica se transformó en una línea recta muy útil para el estudio
cinético de las enzimas.
[ ]
[ ]SK
SV
V
m
o
+
⋅
= max
⇒
ENZIMAS: CINÉTCA ENZIMÁTICA](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-38-320.jpg)
![ENZIMAS: CINÉTICA ENZIMÁTICA
KM (Cte de Michaelis-Menten)
Importancia
Km = [ S ] fisiológica ⇒ V enzimática a [ ]
fisiológica
Afinidad por el S (especificidad): ↑ KM ⇒ ↓
Afinidad
Km a partir de la ecuación de Vo de M-M](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-39-320.jpg)



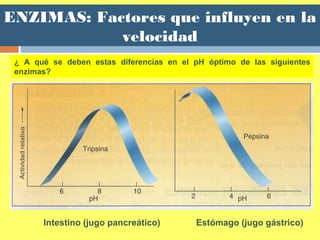
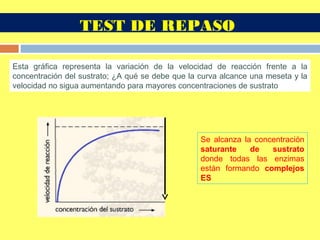
![ENZIMAS: Factores que influyen en la
velocidad
Influencia de la concentración del SUSTRATO
Exponencial (Hipérbole) : al aumentar la [S] => más
centros activos ocupados => la velocidad de la reacción
aumenta hasta que se saturan todos los centros activos =>
velocidad es máxima y constante.](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-44-320.jpg)













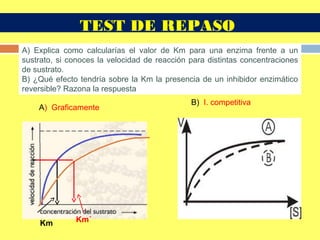
![ENZIMAS: Regulación de la Actividad enzimática
Inhibición competitiva: la Km aparente del
sustrato aumentará en presencia del inhibidor (es decir, será
precisa una [S] superior para alcanzar 1/2 vmáx). Por lo tanto, en la
cinética se refleja como una disminución de la afinidad de E por S.
El inhibidor compite con el
sustrato
La velocidad máxima no
esta afectada
La KM se altera
Se supera con el aumento
de la [S].](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-59-320.jpg)

![ENZIMAS: Regulación de la Actividad enzimática
Vmax cte
↑ Km
Ejemplo:
[I1] <[I2] =>
-1/ [KM] = -1 =>[KM] = 1 mM con I2
-1/ [KM] = -2 => [KM] = 0,5 mM con I1
-1/ [KM] = -3 =>[KM] = 0,33 mM con S (sin I)
1 mM>0,5>0,33mM
KM (aparente con I2)(menos afinidad)>KM
(aparente con I1)> KM (aparente con S)
(más afinidad9 =>
A medida que [I] => KM ,aparente
de la E por el S, (tiene menos afinidad
por la E)
[I1]
[I2]](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-61-320.jpg)


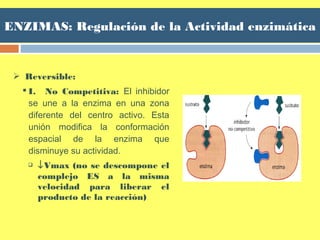

![ENZIMAS: Regulación de la Actividad enzimática
Inhibición no competitiva
La velocidad máxima
se disminuye
La KM es normal
No se supera con el
aumento de [S]](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-66-320.jpg)

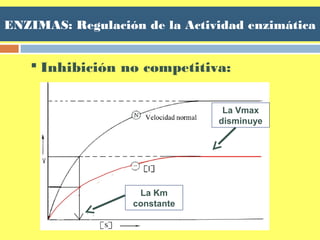
![ENZIMAS: Regulación de la Actividad enzimática
Inhibición no competitiva:
En presencia del I => la vmáx
(es decir, no puede ser
compensada su presencia por
elevadas [S]) pero la Km
aparente no varía (o sea, que a
la misma [S] se alcanza la 1/2
vmáx correspondiente a la
presencia del inhibidor). En
realidad la afinidad de E por S
sí ha disminuido realmente
(aunque no "aparentemente").](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-69-320.jpg)
![ENZIMAS: Regulación de la Actividad enzimática
Ejemplo:
[I1] <[I2] => [KM] = cte
Vmáx disminuye a medida que aumenta
la [I]
INC:
↓Vmáx
Km cte
[I2]
[I1]](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-70-320.jpg)



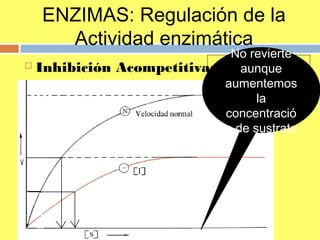
![ENZIMAS: Regulación de la Actividad enzimática
Inhibición Acompetitiva: con un aumento de I aumenta la KM aparente
en la misma proporción que la vmáx disminuye (como el I se une al complejo
ES, su presencia se manifiesta también a elevadas [S], por lo que
disminuye vmáx).
¿Por qué es
irreversible? No revierte aunque
aumentemos la
concentración de
sustrato](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-75-320.jpg)




![1. NOMENCLATURA ANTIGUA: SUFIJO -asa
• Nombre de la fuente u origen del enzima: Pancreasa
• Nombre del sustrato: Proteasa
• Tipo de reacción catalizada: Hidrolasa
2. NOMENCLATURA ACTUAL:
Enzyme Commission [E.C.] de la IUBMB
• Clasificación de enzimas (6 clases)
• Asignación de código E.C.: 1.1.1.1
• Nombre sistemático:
Sustrato-coenzima-Tipo de Reacción -asa
Etanol NAD+
Oxidorreductasa
1. NOMENCLATURA ANTIGUA: SUFIJO -asa
• Nombre de la fuente u origen del enzima: Pancreasa
• Nombre del sustrato: Proteasa
• Tipo de reacción catalizada: Hidrolasa
2. NOMENCLATURA ACTUAL:
Enzyme Commission [E.C.] de la IUBMB
• Clasificación de enzimas (6 clases)
• Asignación de código E.C.: 1.1.1.1
• Nombre sistemático:
Sustrato-coenzima-Tipo de Reacción -asa
Etanol NAD+
Oxidorreductasa](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-81-320.jpg)

![CLASE TIPO DE REACCIÓN CATALIZADA
1. OXIDO-REDUCTASAS Transferencia de electrones
20 subclases Sred + S’ox ↔ Sox + S’red
2. TRANSFERASAS Transferencia de grupos
9 subclases S-grupo + S’ ↔ S’-grupo + S
3. HIDROLASAS Rotura hidrolítica de enlaces
11 subclases A-B + H2O ↔ A-H + B-OH
4. LIASAS Rotura de enlaces A-B → A+B
7 subclases Salida de grupos CX-CY → C=C + X-Y
Adición a dobles enlaces C=C + XY → CX-CY
5. ISOMERASAS Cambios internos
6 subclases Transferencias internas de grupos
6. LIGASAS Formación de enlaces mediante reacciones de
5 subclases condensación con gasto de energía (ATP)
CLASE TIPO DE REACCIÓN CATALIZADA
1. OXIDO-REDUCTASAS Transferencia de electrones
20 subclases Sred + S’ox ↔ Sox + S’red
2. TRANSFERASAS Transferencia de grupos
9 subclases S-grupo + S’ ↔ S’-grupo + S
3. HIDROLASAS Rotura hidrolítica de enlaces
11 subclases A-B + H2O ↔ A-H + B-OH
4. LIASAS Rotura de enlaces A-B → A+B
7 subclases Salida de grupos CX-CY → C=C + X-Y
Adición a dobles enlaces C=C + XY → CX-CY
5. ISOMERASAS Cambios internos
6 subclases Transferencias internas de grupos
6. LIGASAS Formación de enlaces mediante reacciones de
5 subclases condensación con gasto de energía (ATP)
Clasificación de los EnzimasClasificación de los Enzimas
International Union of Biochemistry and Molecular Biology [IUBMB]](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-83-320.jpg)

![Define el concepto de cofactor enzimático
Grupo molecular no proteico que complementa al enzima ( a nivel del c. activo)
¿Qué papel juega el cofactor en el proceso catalítico?
Aporta g. funcionales al c. activo:
Interviene directamente en la catálisis ,
Une ES,
Moldea definitivamente el E.U
Cita algún ejemplo de cofactor enzimático:
FAD, NAD+, cationes, grupo prostético, etc.
Define los siguientes conceptos referidos a enzimas:
Km:
Concentración de sustrato necesaria para alcanzar la mitad de la velocidad
mázima de un proceso enzimático.
Catálisis:
Disminución de la energía de activación por la acción de un catalizador (3 etapas)
con el fin de aumentar la velocidad.
Velocidad del proceso enzimático:
V = [ P ] / tiempo, en moles / L / minuto.
TEST DE REPASO](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-87-320.jpg)







![En un cultivo de bacterias, la velocidad de reacción de un enzima E fue de 20 µg/min
para una concentración de sustrato de 3 mM. Si la concentración de
sustrato es igual o superior a 7 mM, la velocidad no supera los 40 µg/min. Al añadir una
cierta cantidad de inhibidor competitivo, la velocidad de la reacción fue de 20 µg/min
para una concentración de sustrato de 8 mM. Calcúlese la Km, la Vmax y la Km´.
a)Vmax: Si para una [S] ≥ 7 mM la velocidad es 40 µg/min, la Vmax=40 µg/min
b) Km: ½ Vmax será 20 µg/min, como esta velocidad se consigue con una [S]
= 3 mM, la Km = 3 mM
Otra forma es utilizando la ecuación de Michaelis:
Km +3 = 120 / 20 Km = 6 – 3 = 3 mM/L
c) Como es un inhibidor competitivo Vmax = Vmax´= 40 µg/min y ½ Vmax´= 20 µg/min. Esta
velocidad se alcanza con una [S] de 8 mM en presencia de inhibidor, por lo tanto Km´= 8 mM.
Vo = Vmax [S] / Km + [S] 20 = 40 x 3 / Km + 3
TEST DE REPASO](https://image.slidesharecdn.com/tema5enzimas-141123172041-conversion-gate02/85/Tema-5-enzimas-95-320.jpg)

