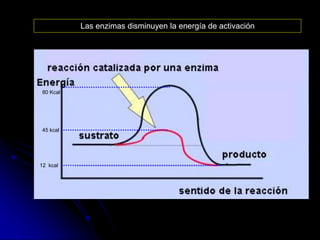
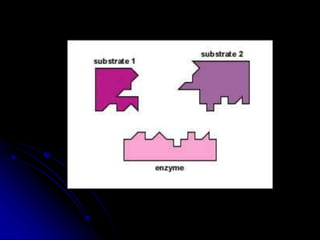
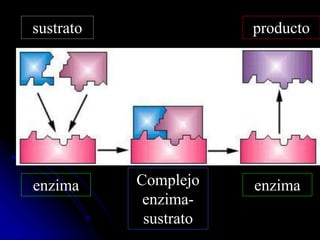
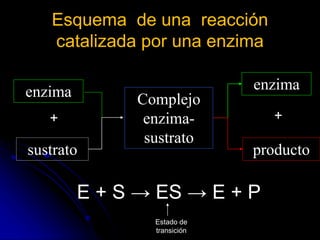
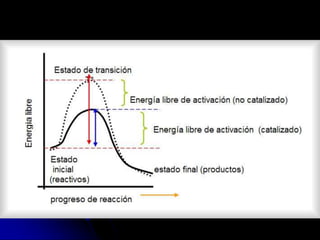
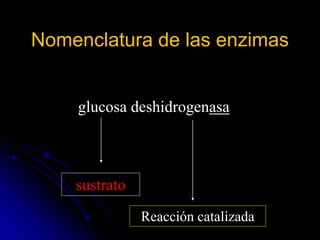
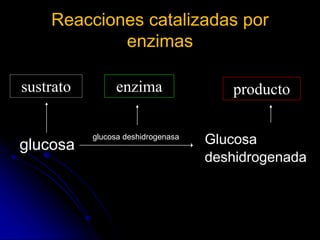
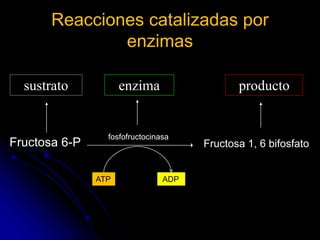
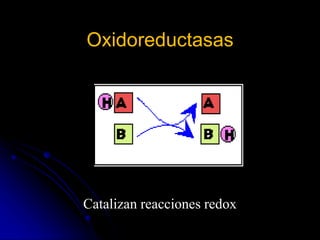
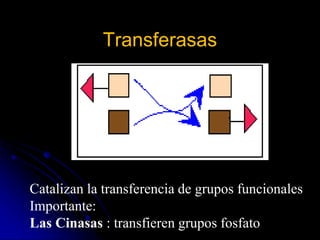
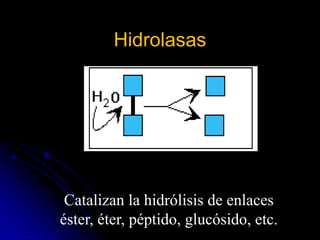
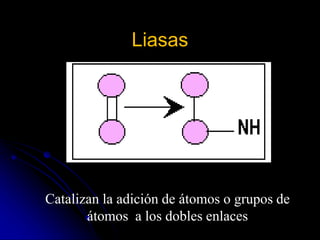
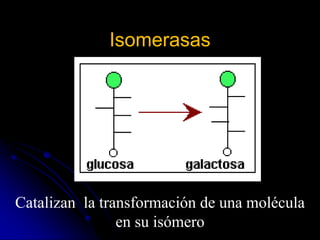
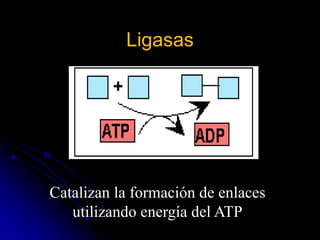
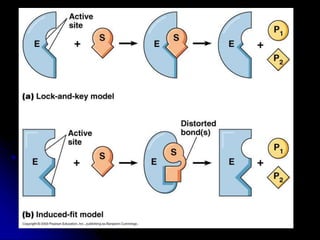
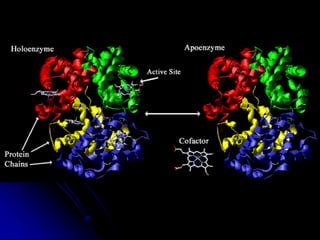
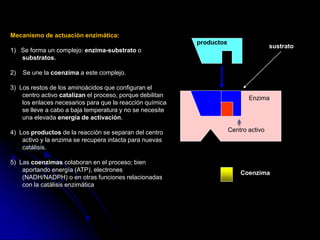
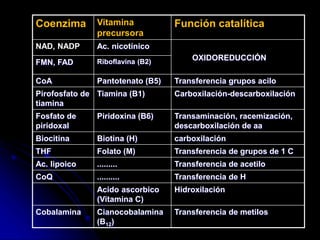
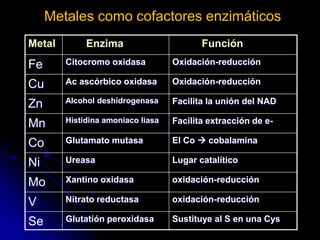
El documento trata sobre la termodinámica y las enzimas. Explica que las enzimas aceleran las reacciones químicas en el cuerpo humano al disminuir la energía de activación requerida, permitiendo que las reacciones ocurran a la temperatura corporal de 37°C. También describe las características generales de las enzimas como catalizadores proteicos específicos, y los diferentes tipos de coenzimas y cofactores metálicos que pueden requerir.

![G = Gproductos Greactivos
-
A +
D
B C +
Keq =
[C] [D]
[A] [B]
REACTIVOS PRODUCTOS](https://image.slidesharecdn.com/aula10enzimas-220804134712-de41cca8/85/Enzimas-2-320.jpg)