Las enzimas son proteínas que aceleran las reacciones bioquímicas actuando como catalizadores. Funcionan disminuyendo la energía de activación de las reacciones que catalizan, lo que aumenta sustancialmente su velocidad. Las enzimas se unen específicamente a sus sustratos y aceleran las reacciones de manera estereoespecífica y con alta especificidad.












![Ventajas de las enzimas sobre los catalizadores
inorgánicos
Velocidades de reacción más elevadas, son más eficientes.
(105- 1017)
Condiciones de reacción más suaves,
(T<100 °C, Presión atmosférica, pH fisiológico)
Mayor especificidad de reacción, y
(sustratos, reactivos, no subproductos)
Capacidad para la regulación
control alostérico, modificación covalente, [enzima]](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-13-320.jpg)




























![Velocidad máxima (Vmax)
• Es la velocidad límite a la que tiende la reacción
catalizada por enzimas a concentraciones saturantes
del sustrato, es decir cuando toda la enzima está
como ES.
Vmax = kcat[E]total
• Su valor cambia durante el proceso de purificación
porque cambia la [E]](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-42-320.jpg)
![Constante catalítica (kcat)
• Sólo puede conocerse cuando se tiene a la enzima pura y
por tanto se conoce su concentración.
kcat = Vmax / [E]total o kcat = Vmax / [sitios activos]
• Si uno de los pasos es limitante de la velocidad, kcat es la
constante de velocidad de este paso.
• A kcat también se le conoce como número de recambio,
porque indica el número máximo de ciclos catalíticos por sitio
activo y por unidad de tiempo.](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-43-320.jpg)








![Transformaciones de la ecuación de velocidad
de Michaelis Menten
Lineal
1/v vs 1/[S] (Dobles recíprocos o Lineweaver-Burk)
Sigmoidal
v versus log S (semilogarítmica)](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-52-320.jpg)


![Gráfica sigmoidal
(velocidad inicial vs log [S])](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-55-320.jpg)
![Aunque los métodos gráficos
dan una determinación
exacta de la Vmax y Km de
una reacción catalizada por
una enzima, a veces estos
valores pueden estimarse
rápidamente inspeccionando
los valores de Vo al
incrementar [S]. Estimar
Vmax y Km de la reacción
catalizada enzimáticamente
con los siguientes datos
obtenidos:
[S]
(M)
V0
(µmol/mL min)
2.5 X 10-6 28
4 X 10-6 40
1 X 10-5 70
2 X 10-5 95
4 X 10-5 112
1 X 10-4 128
2 X 10-3 139
1 X 10-2 140
*Ejercicio 6. Estimación de Vmax y Km por inspección
Vmax = 140 μmol/mL min
Km = 1 x 10-5 M](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-56-320.jpg)







![Su efecto se contrarresta cuando ↑[S].
Compiten con el sustrato por su sitio de unión.
INHIBICIÓN COMPETITIVA
El inhibidor se une a la enzima libre interfiriendo con la
unión del sustrato
Reduce la concentración de enzima libre disponible.](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-64-320.jpg)






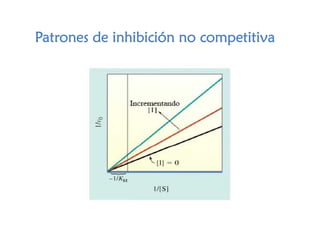


![a) Presentar en un análisis gráfico de dobles recíprocos el patrón
de inhibición.
b) Determinar las constantes cinéticas (Km y Vmax) de la enzima en
ausencia y presencia de los inhibidores.
c) Para cada inhibidor determinar el tipo de inhibición.
V0 (µmol/mL s)
[S] (mM) Control Inhibidor 1 Inhibidor 2
1 2.50 1.17 0.77
2 4.00 2.10 1.25
5 6.30 4.00 2.00
10 7.60 5.70 2.45
20 8.50 7.20 2.68](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-74-320.jpg)
























![Enzimas con cooperatividad positiva
La unión del sustrato es cada vez más fácil a medida que la
enzima se satura más y más.
Dependencia sigmoidal de la velocidad inicial vs [S].
Enzimas con cooperatividad negativa
La unión del sustrato es cada vez más difícil a medida que la
enzima se satura más y más.
Dependencia hiperbólica de la velocidad inicial vs [S].](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-100-320.jpg)
































![k(T): constante cinética (dependiente de la temperatura)
A: factor preexponencial o factor de frecuencia. Refleja la frecuencia
de las colisiones.
Ea: energía de activación, expresada en kJ/mol.
R: constante universal de los gases. Su valor es 8,3143 J·K-1·mol-1
T: temperatura absoluta [K]
Ecuación de Arrhenius](https://image.slidesharecdn.com/1-170312014631/85/Enzimas-24470-133-320.jpg)











