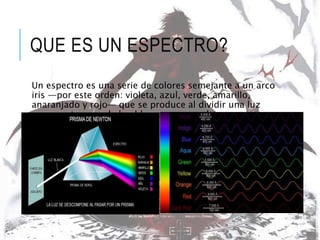
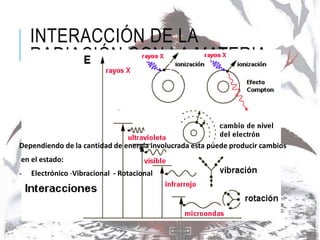
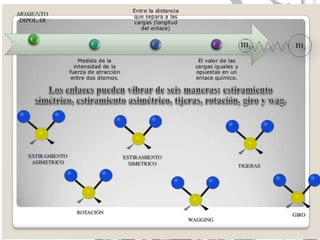
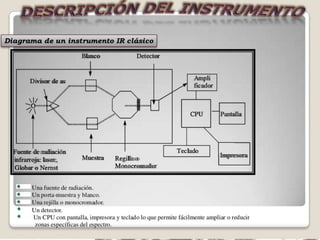
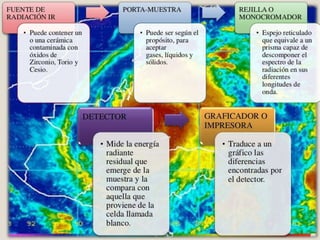
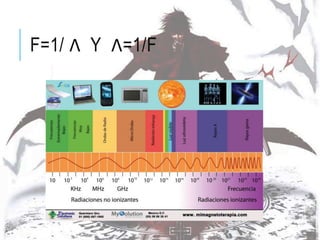
La espectroscopia estudia la interacción entre la radiación electromagnética y la materia mediante la absorción o emisión de energía radiante. Un espectro muestra la distribución de la radiación electromagnética de un objeto a través de las diferentes longitudes de onda. La espectroscopia puede analizar los estados cuánticos y las transiciones entre ellos inducidas por la radiación electromagnética.