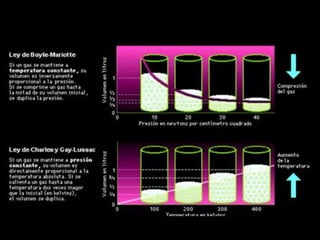
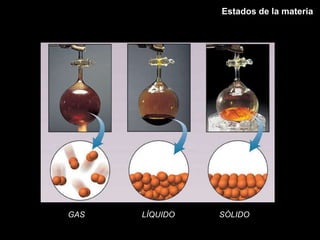
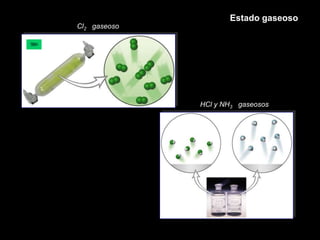
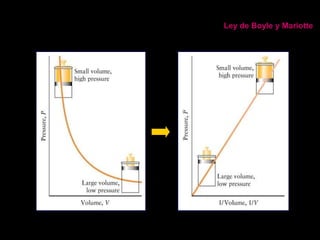
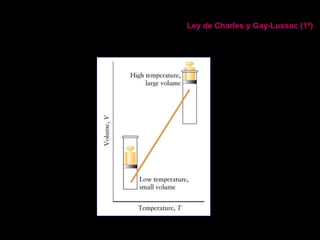
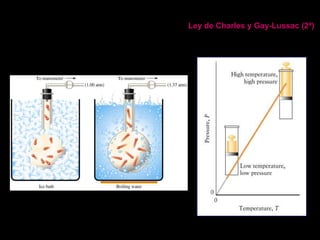
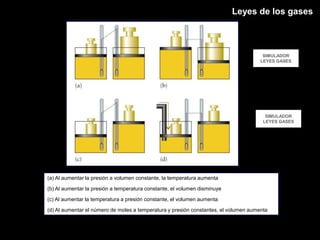
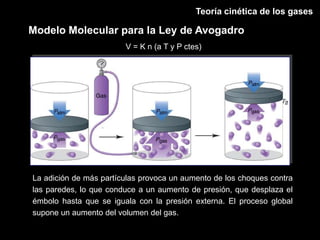
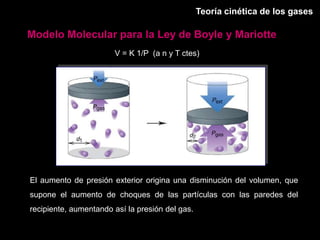
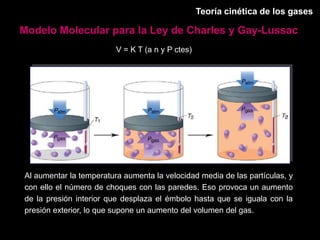
Este documento describe las leyes fundamentales de los gases, incluyendo las leyes de Boyle, Charles y Avogadro. Explica que los gases ideales se comportan de acuerdo a la ecuación de estado PV=nRT. También presenta el modelo cinético de los gases, el cual describe el movimiento aleatorio de las moléculas y cómo esto da cuenta de las observaciones macroscópicas descritas por las leyes de los gases.