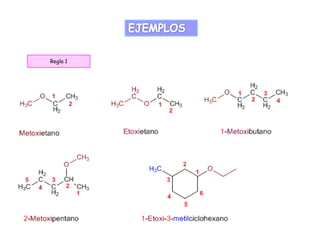
El documento presenta información sobre diferentes compuestos orgánicos como alcoholes, éteres, epóxidos, aldehídos, cetonas, ácidos carboxílicos, ésteres, aminas y amidas. Explica sus características principales, nomenclatura y aplicaciones. También incluye una lista de referencias bibliográficas sobre estos temas.