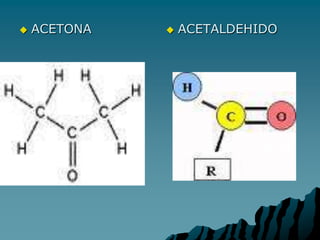
Este documento describe diferentes grupos funcionales orgánicos y sus propiedades. Incluye grupos como alcoholes, aldehídos, cetonas, ácidos carboxílicos, éteres, ésteres, anhídridos, aminas, amidas y nitrilos. Cada grupo funcional confiere características químicas específicas a las moléculas que los contienen y determina cómo reaccionarán químicamente.