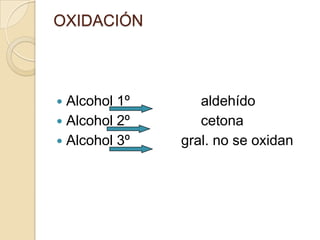
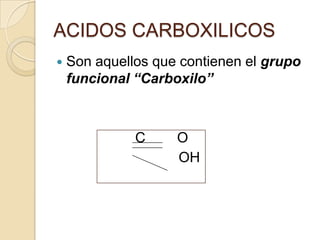
El documento describe diferentes grupos funcionales orgánicos, incluyendo alcoholes, aldehídos, cetonas, ácidos carboxílicos, ésteres, éteres, anhídridos, aminas, amidas y nitrilos. Explica sus propiedades químicas, físicas y cómo se clasifican y nombran según su estructura molecular.