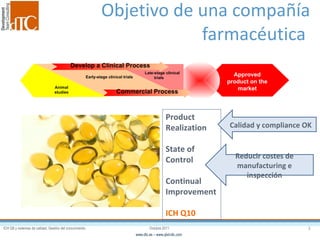
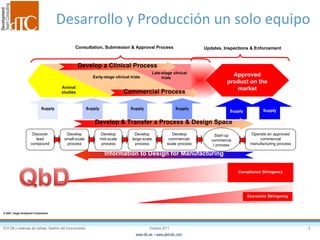
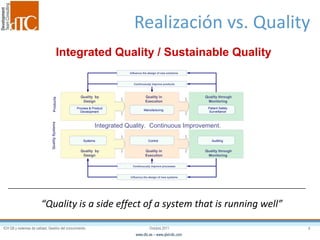
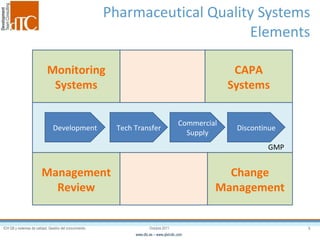
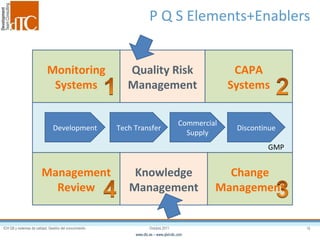
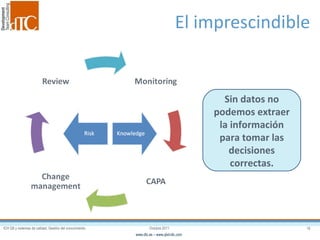
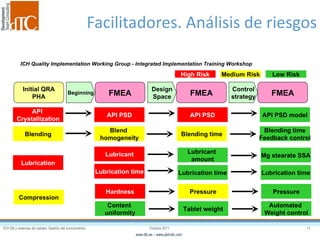
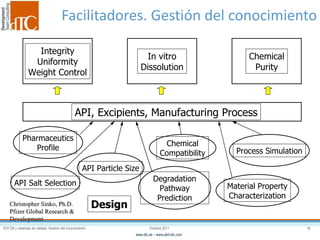
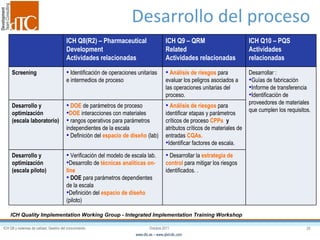
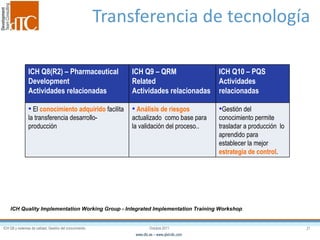
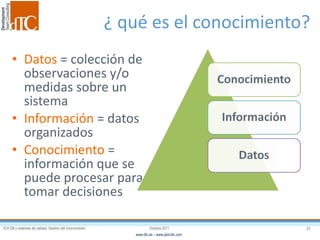
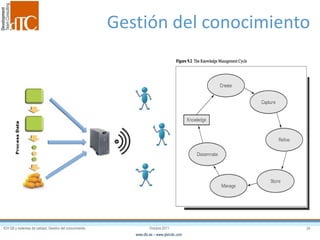
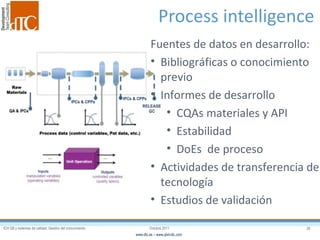
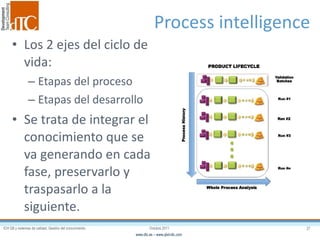
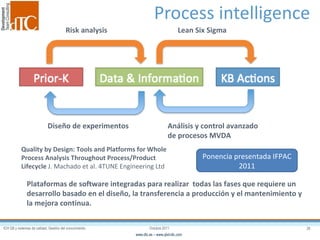
El documento describe los elementos clave de un sistema de calidad farmacéutico (PQS) según ICH Q10, incluyendo la monitorización, sistemas CAPA, revisión de gestión y gestión de cambios. También discute facilitadores como el análisis de riesgos y la gestión del conocimiento, los cuales son fundamentales para integrar la calidad en todo el ciclo de vida del producto, desde el desarrollo hasta la producción comercial.