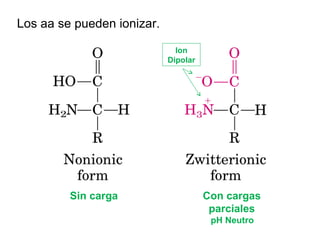
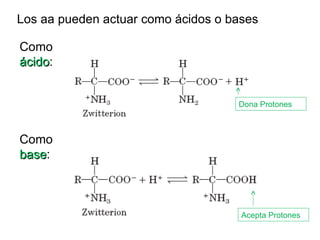
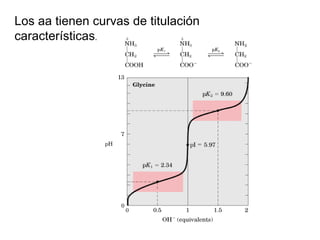
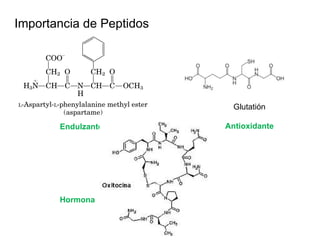
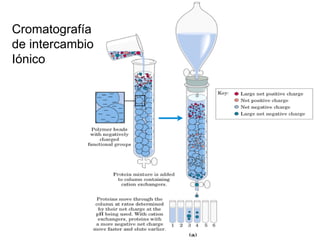
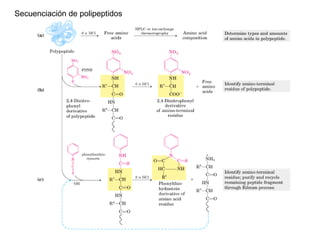
El documento presenta preguntas sobre conceptos relacionados con aminoácidos, proteínas y su estudio. Incluye preguntas sobre la estructura química de los aminoácidos, su representación, enantiómeros, grupos funcionales, puentes disulfuro, pKa y curvas de titulación. También cubre temas como la formación de enlaces peptídicos, estructura primaria de proteínas, técnicas para su separación y purificación como cromatografía y electroforesis, y conceptos como actividad enzim
![Agua y pH 1) ¿Cuál es el pH de una solución con 1.3 X 10 -7 mol/l de [H + ]? 6.88 b) 7.99 c) 0.11 d) -0.77 e) 14.68 2) ¿Cuál es la concentración de protones ([H + ]) en una solución con pH 7.4? 6 X 10 -4 b) 3.98 X10 -8 c) 1.4 X 10 -16 d) -3 X 10 -7 e) 1.6 X 10 8 3) Los puentes de hidrógeno se pueden formar: a) Exclusivamente entre dos átomos de H . b) Exclusivamente entre un H y un O. c) Se forman exclusivamente entre un átomo no electronegativo y otro electronegativo. d) Se forman exclusivamente entre un H unido a un átomo electronegativo y otro átomo electronegativo. 4) Catión más importante en el líquido extracelular Cl - b) K + c) Na + d) Ca +2 e) Mg +2 5) Concentración en el interior de la célula del potasio es de: a) 150 mEq/L b) 300 mEq/L c) 50 mEq/L d) 3.5 mEq/L e) 5.5 mEq/L](https://image.slidesharecdn.com/aayprotenas-110901205848-phpapp02/85/Aa-y-proteinas-1-320.jpg)