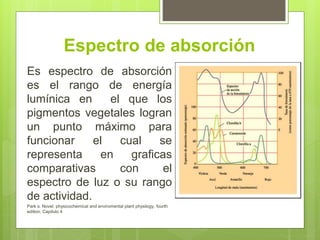
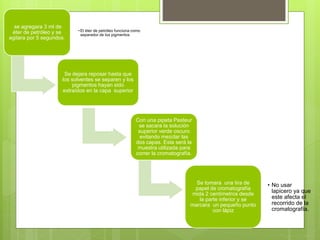
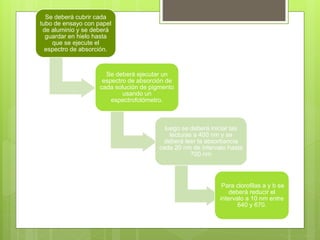
Los pigmentos vegetales como la clorofila, carotenos y xantofilas dan color a las plantas al absorber y reflejar la luz. Estos pigmentos se pueden separar usando cromatografía y su espectro de absorción se puede medir con un espectrofotómetro para determinar en qué rango de longitudes de onda absorben mejor la luz.