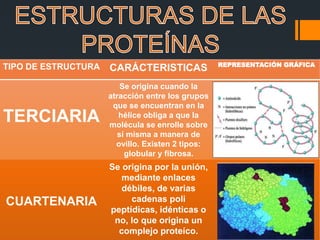
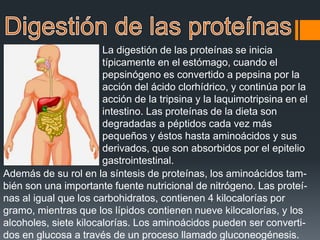
Las proteínas son biomoléculas formadas por cadenas de aminoácidos que desempeñan funciones esenciales para la vida. Cumplen roles estructurales, funcionales como enzimas y hormonas, y de transporte. Son indispensables para el crecimiento y desarrollo de los organismos.