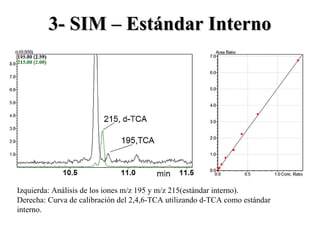
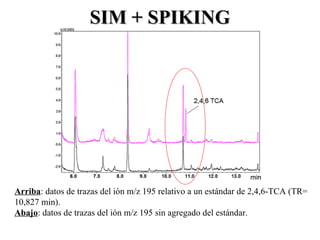
El documento proporciona información sobre los mecanismos de fragmentación que ocurren en espectrometría de masas. Describe procesos como el clivaje alfa, clivaje sigma, reordenamiento del hidrógeno gamma y rupturas características de aromáticos. También explica cómo se utiliza la espectrometría de masas de forma cuantitativa mediante la selección de iones específicos y el uso de patrones y estándares internos.