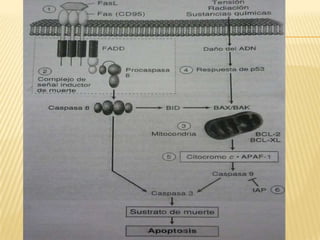
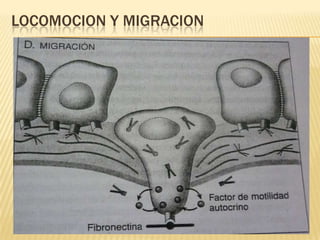
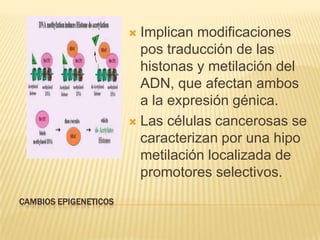
Este documento resume los principales mecanismos de desregulación del cáncer, incluyendo la evasión de la apoptosis, la angiogénesis, la invasión y metástasis, los cambios cromosómicos y epigenéticos, y el papel de los microRNAs. Describe cómo las mutaciones en oncogenes y genes supresores de tumores conducen al crecimiento anormal de células y cómo los tumores utilizan varios procesos para propagarse en el cuerpo.