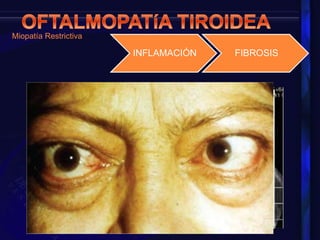
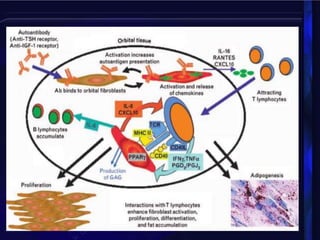
La orbitopatía tiroidea es la primera causa de patología orbitaria, afectando a entre el 25-50% de pacientes con enfermedad de Graves. Se presenta más en mujeres que en hombres de 30 a 50 años y puede manifestarse hasta 10 años antes o después del diagnóstico de la enfermedad tiroidea. Sus síntomas incluyen proptosis, disfunción de los músculos oculares, edema de párpados e hiperemia conjuntival.