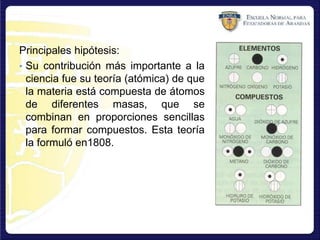
La teoría atómica de Dalton establece que (1) la materia está compuesta de átomos indivisibles de diferentes elementos, (2) los átomos de un elemento son iguales entre sí pero diferentes de otros elementos, y (3) las reacciones químicas implican la separación, combinación o reordenamiento de átomos. Dalton también formuló la ley de proporciones múltiples.