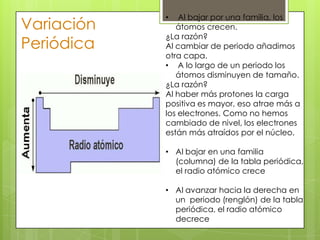
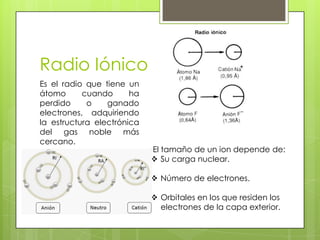
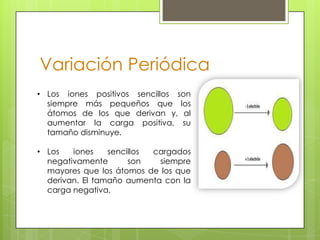
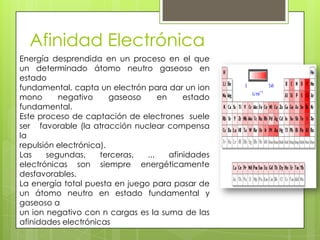
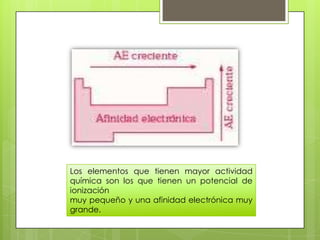
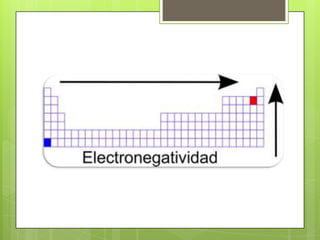
El documento describe la variación periódica de varias propiedades atómicas como el radio atómico, el radio iónico, el potencial de ionización, la afinidad electrónica y la electronegatividad a lo largo de la tabla periódica. Explica que estas propiedades tienden a aumentar al moverse de izquierda a derecha dentro de un período y tienden a disminuir al moverse de arriba a abajo dentro de un grupo, y que estas variaciones están relacionadas con el número atómico y el número de electrones. Tamb