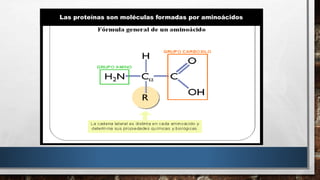
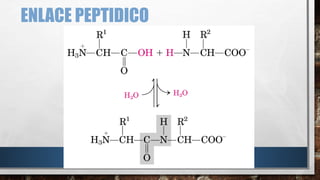
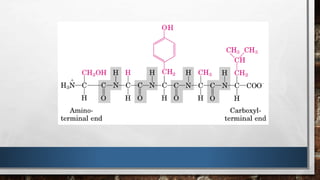
Las proteínas son biomoléculas formadas por la unión de aminoácidos mediante enlaces peptídicos. Existen distintos niveles de estructuración de las proteínas, desde la estructura primaria que es la secuencia lineal de aminoácidos, hasta la estructura cuaternaria que es la asociación de subunidades proteicas. Las proteínas cumplen funciones esenciales y diversas en el cuerpo.








































![Estructura de la Enzima:
TERCIARIA
Enzyme_function_and_inhibition_(with_audio_narration)_[www.bajaryoutube.com].flv
Sitio
activo
sitio activo](https://image.slidesharecdn.com/proteinas-141111113209-conversion-gate01/85/Proteinas-46-320.jpg)

![¿Cómo actúa la Enzima (E) sobre el
Sustrato (S) Enzyme_Action_[www.bajaryoutube.com].flv](https://image.slidesharecdn.com/proteinas-141111113209-conversion-gate01/85/Proteinas-48-320.jpg)
![UNIÓN SUSTRATO CON EL SITIO ACTIVO DE LA ENZIMA
Enzyme_function_and_inhibition_(with_audio_narration)
_[www.bajaryoutube.com].flv](https://image.slidesharecdn.com/proteinas-141111113209-conversion-gate01/85/Proteinas-50-320.jpg)

