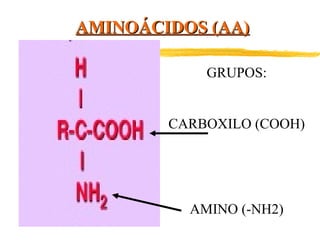
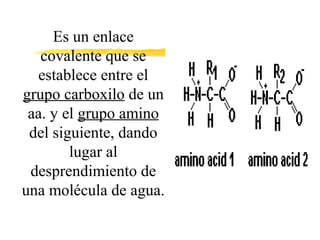
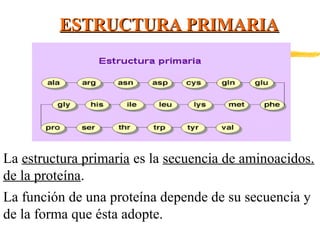
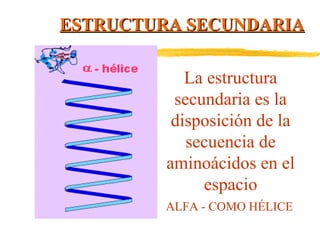
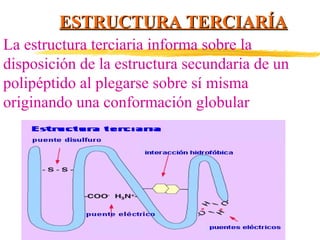
Las proteínas están formadas por aminoácidos unidos mediante enlaces peptídicos. Presentan estructuras primaria, secundaria, terciaria y cuaternaria. Cumplen funciones estructurales, enzimáticas, de defensa, transporte y reserva en los organismos vivos. Algunos tipos de proteínas son las globulares, como las albúminas y hormonas, y las heteroproteínas como las lipoproteínas y nucleoproteínas.