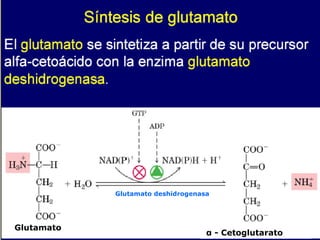
El documento describe la digestión y metabolismo de proteínas y aminoácidos. Explica que las proteínas están formadas por cadenas de 20 tipos diferentes de aminoácidos unidos por enlaces peptídicos. Los aminoácidos se clasifican en esenciales y no esenciales. También describe la digestión, absorción, transporte y destinos metabólicos de los aminoácidos en el organismo.