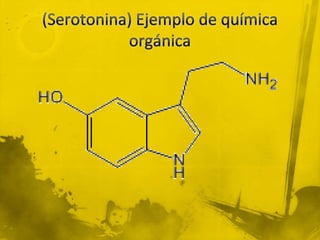
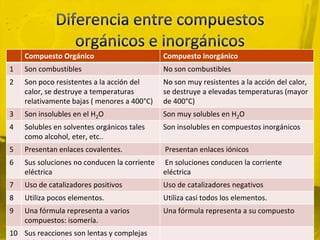
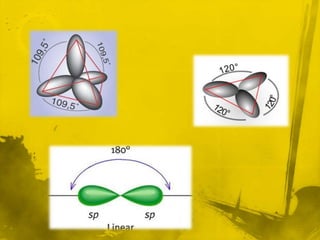
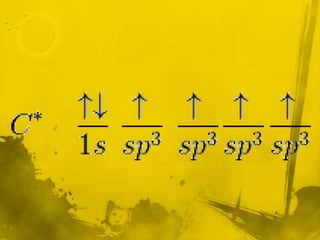Este documento presenta información sobre la química orgánica e inorgánica. Explica las diferencias entre compuestos orgánicos e inorgánicos, y describe varios tipos de enlaces químicos como enlaces sigma, pi, hibridación sp, sp2 y sp3. También define conceptos como fórmula molecular, estructura molecular y modelo de Lewis.