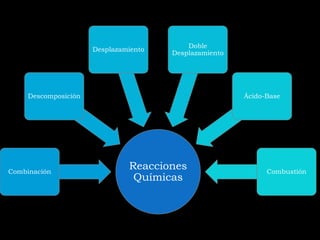
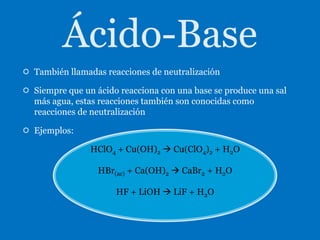
Este documento presenta información sobre diferentes tipos de reacciones químicas, incluyendo combinaciones, descomposiciones, desplazamientos, ácido-base y combustión. Explica conceptos como los estados de oxidación de los elementos y los productos que se forman en cada tipo de reacción.