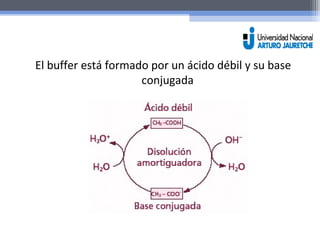
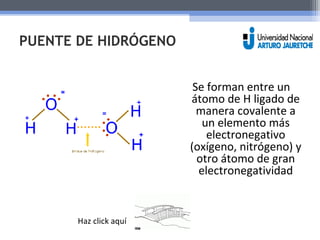
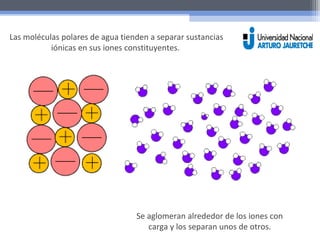
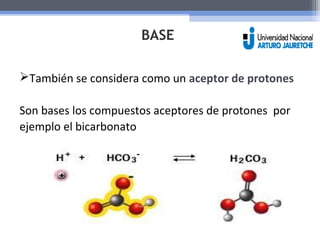
El documento resume las propiedades fundamentales del agua y conceptos químicos relacionados. Explica que el agua es una molécula polar con cargas positivas y negativas que le permiten actuar como solvente ideal. Se forman puentes de hidrógeno entre moléculas de agua y otras sustancias polares. También define ácidos, bases y el pH, y explica el rol de los tampones en mantener el pH estable.









![CONCEPTO DE pH
pH “potencia de hidrógeno”indica la concentración de iones H+
• pH = - log [H+]
• AGUA 7= - log [10-7] pH neutro
Es el grado de acidez o alcalinidad de una solución](https://image.slidesharecdn.com/semana2-140921164752-phpapp02/85/Semana-2-13-320.jpg)