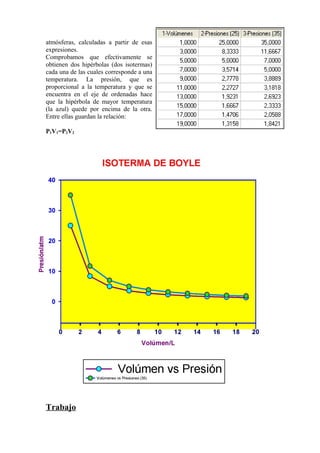
Robert Boyle fue un químico inglés del siglo XVII que realizó importantes estudios sobre los gases. En 1661 enunció la ley que lleva su nombre, la cual establece que para una temperatura dada, el producto de la presión y el volumen de un gas permanece constante. Más tarde, Boyle utilizó esta ley para estudiar experimentalmente la relación entre la presión y el volumen de los gases, representando sus resultados en curvas llamadas isotermas que ilustran cómo varía la presión de un gas a medida que cambia su volumen a una temper


![w = −∑ PdV = ∑ − Pext (V2 − V1 )
2
∫1
w = −[ (1,3158 atm (19 L − 9 L) ) + ( 2,7778atm( 9L - 1L) ) ] = −35,38 atmxL
Pasamos a Julios:
101 ,3 J
− 35 ,38 atm × L = −3584 ,03 J
1atm × L](https://image.slidesharecdn.com/seminario-rep-graf-121210134947-phpapp02/85/Isoterma-de-Boyle-5-320.jpg)
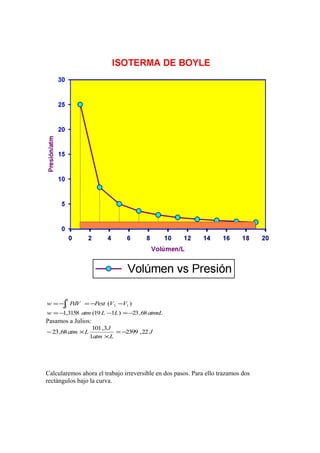
![Calcularemos finalmente el trabajo irreversible en tres pasos. Para ello trazamos tres
rectángulos bajo la curva.
w = −∑ PdV = ∑ − Pext (V2 − V1 )
2
∫1
w = −[ (1,3158 atm (19 L − 15 L) ) + (1,6667atm( 15L - 5L) ) + ( 5atm (5 L − 1L ) ] = −41,93atmxL](https://image.slidesharecdn.com/seminario-rep-graf-121210134947-phpapp02/85/Isoterma-de-Boyle-6-320.jpg)
