2 primera ley
•
0 recomendaciones•5,689 vistas
La Primera Ley de la Termodinámica establece que la energía total de un sistema aislado se conserva. Define conceptos clave como trabajo (W), calor (Q) y energía interna (U), y establece que los cambios en la energía interna de un sistema son iguales a la suma del calor y el trabajo transferidos al sistema.
Denunciar
Compartir
Denunciar
Compartir
Descargar para leer sin conexión
Recomendados
1º 2º 3º ley de la termodinámica

La primera ley de la termodinámica establece que la variación de la energía interna de un sistema (ΔU) es igual a la cantidad de calor (Q) absorbido por el sistema más el trabajo (W) realizado sobre el sistema. La energía interna depende solo del estado del sistema, mientras que Q y W dependen del proceso seguido. La primera ley se aplica a cualquier proceso termodinámico y es fundamental para entender conceptos como entalpía y reacciones químicas.
Ejercicios tipo examen

Este documento presenta varios ejercicios sobre gases ideales y reales utilizando la ecuación de van der Waals. El primer ejercicio grafica isotermas para el argón a diferentes temperaturas. El segundo analiza las isotermas y encuentra que a temperaturas más altas el argón se comporta como un gas ideal, mientras que a temperaturas más bajas se observan desviaciones debido a la formación de la fase líquida. Los ejercicios siguientes calculan el factor de compresibilidad para CO2 y comparan gases a igual estado correspondiente, determinando
Calor especifico de un metal. Informe de fisica By Jairo A. Marchena M. USB. ...

Calor especifico de un metal. Informe de fisica By Jairo A. Marchena M. USB. ...Universidad Simon Bolivar (Bquilla-Col)
El documento presenta los resultados de un experimento para determinar el calor específico de tres metales. Se midió la masa y temperatura inicial de cada metal y del agua, así como la temperatura final de equilibrio. Usando la fórmula del calor específico y los datos recolectados, se calculó el calor específico de cada metal y se identificó uno de ellos como aluminio, con un error porcentual casi nulo del 0%. El experimento cumplió con los objetivos de determinar el calor específico de los metales de manera precisa.Unidad 1: Termodinámica

Contenido Programático de la Unidad
1. Conceptos
1.1. Sistemas, alrededores y universo.
1.2. Tipos de sistemas: abiertos, cerrados y aislados.
1.3. Trabajo. Función de estado.
1.4. Calor. Capacidad calorífica y calor específico.
1.5. Procesos exotérmicos y endotérmicos.
1.6. Energía interna.
2. Trabajo de expansión
2.1. A presión constante.
2.2. Ejercicios.
3. Relación energía, calor y trabajo
3.1. Primera ley de la termodinámica.
3.2. Sistemas con volumen constante.
3.3. Ejercicios.
4. Calor a presión constante
4.1. Entalpía. Definición.
4.2. Entalpía y energía interna. ΔH y ΔE.
4.3. Variación de entalpía en una reacción química.
4.4. Ecuación termoquímica. Definición.
4.5. Aplicación de la estequiometria a los calores de reacción.
4.6. Variación de entalpía en un cambio de estado.
4.7 Entalpías de formación estándar.
4.8. Entalpías de reacción estándar.
4.9. Ejercicios.
5. Desorden de un sistema
5.1. Segunda ley de la termodinámica.
5.2. Entropía. Definición.
5.3. Procesos espontáneos y no espontáneos.
5.4. Variación de la entropía en el universo.
5.5. Variación de la entropía a temperatura constante. Cambio de estado físico.
5.6. Entropía absoluta. Tercera ley de la termodinámica.
. 5.7. Entropía molar estándar.
5.8. Entropía de reacción estándar.
5.9. Ejercicios.
6. Energía libre de Gibbs
6.1. Definición.
6.2. Energía libre estándar de formación.
6.3. Energía libre estándar de reacción.
6.4. La temperatura y los cambios espontáneos.
6.5. Ejercicios.
Deducción Clausius-Clapeyron

Este documento presenta la deducción de la ecuación de Clapeyron y Clausius-Clapeyron para describir el equilibrio entre dos fases de una sustancia pura. Se describe cómo la energía libre de Gibbs debe ser igual en ambas fases para mantener el equilibrio y cómo esto lleva a una ecuación que relaciona el cambio de presión con el cambio de temperatura. También se discuten las ecuaciones para transiciones entre otros estados como sólido-líquido y sólido-sólido.
Van ness capitulo 3 orihuela contreras jose

Este documento presenta una serie de problemas de termodinámica relacionados con fluidos, gases ideales y cambios de estado. En el problema 3.1 se pregunta si es posible transferir energía a un fluido incompresible en forma de trabajo y cómo cambia su energía interna al variar la presión. En el problema 3.2 se pide calcular la presión a la que debe comprimirse agua para que su densidad cambie en un 1%, dadas sus propiedades. En el problema 3.3 se pide derivar una expresión para la compresibilidad isotérmica consist
INFORME DE LEY DE GASES

Aquí les dejo un trabajo hecho por mi, amigos universitarios,espero que les sirva de algo.atentamente Jhon, en el Dota Loco24 ya saben.
Gases reales

Este documento describe las desviaciones del comportamiento de los gases reales de la ley de los gases ideales. Los gases reales no siguen perfectamente la relación de presión, volumen y temperatura dada por la ecuación de los gases ideales. El factor de compresibilidad depende de la temperatura y la presión y no es igual a uno como en los gases ideales. La ecuación de Van der Waals mejora la descripción de los gases reales al tener en cuenta el volumen molecular y las fuerzas de atracción entre moléculas.
Recomendados
1º 2º 3º ley de la termodinámica

La primera ley de la termodinámica establece que la variación de la energía interna de un sistema (ΔU) es igual a la cantidad de calor (Q) absorbido por el sistema más el trabajo (W) realizado sobre el sistema. La energía interna depende solo del estado del sistema, mientras que Q y W dependen del proceso seguido. La primera ley se aplica a cualquier proceso termodinámico y es fundamental para entender conceptos como entalpía y reacciones químicas.
Ejercicios tipo examen

Este documento presenta varios ejercicios sobre gases ideales y reales utilizando la ecuación de van der Waals. El primer ejercicio grafica isotermas para el argón a diferentes temperaturas. El segundo analiza las isotermas y encuentra que a temperaturas más altas el argón se comporta como un gas ideal, mientras que a temperaturas más bajas se observan desviaciones debido a la formación de la fase líquida. Los ejercicios siguientes calculan el factor de compresibilidad para CO2 y comparan gases a igual estado correspondiente, determinando
Calor especifico de un metal. Informe de fisica By Jairo A. Marchena M. USB. ...

Calor especifico de un metal. Informe de fisica By Jairo A. Marchena M. USB. ...Universidad Simon Bolivar (Bquilla-Col)
El documento presenta los resultados de un experimento para determinar el calor específico de tres metales. Se midió la masa y temperatura inicial de cada metal y del agua, así como la temperatura final de equilibrio. Usando la fórmula del calor específico y los datos recolectados, se calculó el calor específico de cada metal y se identificó uno de ellos como aluminio, con un error porcentual casi nulo del 0%. El experimento cumplió con los objetivos de determinar el calor específico de los metales de manera precisa.Unidad 1: Termodinámica

Contenido Programático de la Unidad
1. Conceptos
1.1. Sistemas, alrededores y universo.
1.2. Tipos de sistemas: abiertos, cerrados y aislados.
1.3. Trabajo. Función de estado.
1.4. Calor. Capacidad calorífica y calor específico.
1.5. Procesos exotérmicos y endotérmicos.
1.6. Energía interna.
2. Trabajo de expansión
2.1. A presión constante.
2.2. Ejercicios.
3. Relación energía, calor y trabajo
3.1. Primera ley de la termodinámica.
3.2. Sistemas con volumen constante.
3.3. Ejercicios.
4. Calor a presión constante
4.1. Entalpía. Definición.
4.2. Entalpía y energía interna. ΔH y ΔE.
4.3. Variación de entalpía en una reacción química.
4.4. Ecuación termoquímica. Definición.
4.5. Aplicación de la estequiometria a los calores de reacción.
4.6. Variación de entalpía en un cambio de estado.
4.7 Entalpías de formación estándar.
4.8. Entalpías de reacción estándar.
4.9. Ejercicios.
5. Desorden de un sistema
5.1. Segunda ley de la termodinámica.
5.2. Entropía. Definición.
5.3. Procesos espontáneos y no espontáneos.
5.4. Variación de la entropía en el universo.
5.5. Variación de la entropía a temperatura constante. Cambio de estado físico.
5.6. Entropía absoluta. Tercera ley de la termodinámica.
. 5.7. Entropía molar estándar.
5.8. Entropía de reacción estándar.
5.9. Ejercicios.
6. Energía libre de Gibbs
6.1. Definición.
6.2. Energía libre estándar de formación.
6.3. Energía libre estándar de reacción.
6.4. La temperatura y los cambios espontáneos.
6.5. Ejercicios.
Deducción Clausius-Clapeyron

Este documento presenta la deducción de la ecuación de Clapeyron y Clausius-Clapeyron para describir el equilibrio entre dos fases de una sustancia pura. Se describe cómo la energía libre de Gibbs debe ser igual en ambas fases para mantener el equilibrio y cómo esto lleva a una ecuación que relaciona el cambio de presión con el cambio de temperatura. También se discuten las ecuaciones para transiciones entre otros estados como sólido-líquido y sólido-sólido.
Van ness capitulo 3 orihuela contreras jose

Este documento presenta una serie de problemas de termodinámica relacionados con fluidos, gases ideales y cambios de estado. En el problema 3.1 se pregunta si es posible transferir energía a un fluido incompresible en forma de trabajo y cómo cambia su energía interna al variar la presión. En el problema 3.2 se pide calcular la presión a la que debe comprimirse agua para que su densidad cambie en un 1%, dadas sus propiedades. En el problema 3.3 se pide derivar una expresión para la compresibilidad isotérmica consist
INFORME DE LEY DE GASES

Aquí les dejo un trabajo hecho por mi, amigos universitarios,espero que les sirva de algo.atentamente Jhon, en el Dota Loco24 ya saben.
Gases reales

Este documento describe las desviaciones del comportamiento de los gases reales de la ley de los gases ideales. Los gases reales no siguen perfectamente la relación de presión, volumen y temperatura dada por la ecuación de los gases ideales. El factor de compresibilidad depende de la temperatura y la presión y no es igual a uno como en los gases ideales. La ecuación de Van der Waals mejora la descripción de los gases reales al tener en cuenta el volumen molecular y las fuerzas de atracción entre moléculas.
ECUACIÓN DE ESTADO DEL VIRIAL

Este documento describe las desviaciones de los gases reales de la ley de los gases ideales. Explica que a altas presiones y bajas temperaturas, especialmente cuando el gas está cerca de licuarse, los gases reales no se comportan como los ideales. Introduce el factor de compresión y la ecuación del virial, que relaciona la presión, volumen y temperatura mediante coeficientes viriales que miden las desviaciones del comportamiento ideal.
Termodinamica ejercicios resueltos

Este documento presenta una colección de problemas resueltos de termodinámica dividida en cinco capítulos. El autor, un estudiante de física, recopiló problemas de su asignatura de Termodinámica I y de libros de texto para ofrecer una guía de ayuda a otros estudiantes. Explica haber contrastado las soluciones y pide que le informen de errores para corregirlos. El documento carece de algunos temas pero podría ampliarse en el futuro.
Primera ley de la Termodinamica

La termodinámica estudia la transformación de energía térmica en mecánica y viceversa. La primera ley establece que la energía se conserva en cualquier proceso. El cambio en la energía interna de un sistema es igual al calor absorbido menos el trabajo realizado. Diferentes procesos incluyen isobáricos (presión constante), isotérmicos (temperatura constante), isocóricos (volumen constante) y adiabáticos (sin intercambio de calor).
Segunda Ley Y EntropíA

1. Se presenta un documento sobre la segunda ley de la termodinámica y la entropía. Incluye varios problemas resueltos sobre ciclos termodinámicos ideales, mezcla de sustancias y cálculos de trabajo y cambios de entropía.
2. Se pide calcular el rendimiento de varios motores térmicos ideales que siguen ciclos de procesos como expansión, compresión y calentamiento/enfriamiento.
3. Los problemas tratan conceptos fundamentales de la termodinámica como diagramas
Campo electrico distribuciones continuas de carga clase 4 TE

El documento describe el cálculo del campo eléctrico debido a distribuciones continuas de carga a través de la integración de la ley de Coulomb. Explica cómo calcular el campo eléctrico para cargas puntuales, líneas de carga, superficies y volúmenes. Luego, presenta varios problemas de aplicación que involucran el cálculo del campo eléctrico para barras cargadas, cilindros y objetos compuestos de cubos.
Lab Física B - Informe #12 (Ley de Boyle)

Este documento describe un experimento realizado para verificar la ley de Boyle usando aire a temperatura constante. Se midieron valores de presión y volumen del aire al variar la presión. Al graficar la presión contra el inverso del volumen, se obtuvo una pendiente constante que permitió calcular el número de moles de aire, el cual se mantuvo constante a pesar de los cambios en presión y volumen.
Ley de la difusión de graham

La Ley de la difusión de Graham establece que la velocidad de difusión y efusión de los gases es igual a la raíz cuadrada de sus masas molares, por lo que cuanto mayor sea la masa molecular de un gas, menor será su velocidad de difusión. La Ley de Fick describe matemáticamente la difusión como un proceso que depende del gradiente de concentración, el área de difusión y la difusividad de las especies involucradas.
Informe lab 2

Este informe describe un experimento de calorimetría para medir el calor específico de metales como el aluminio, el cobre y el hierro. Los estudiantes colocaron muestras de cada metal en agua hirviendo y luego las transfirieron a agua a temperatura ambiente para medir los cambios de temperatura. Esto les permitió calcular el calor cedido por cada metal y determinar su calor específico. También realizaron un experimento adicional con botellas de agua y frutiño para observar cómo se distribuye el cal
Etapas en una reacción catalítica.bueno

El documento describe los diferentes procesos involucrados en una reacción catalítica heterogénea, incluyendo la difusión de reactivos y productos, la adsorción, reacción y desorción. Se explican modelos cinéticos como Langmuir-Hinshelwood y Eley-Rideal para describir la velocidad de reacción. También se detalla el procedimiento para derivar ecuaciones de velocidad a partir de mecanismos de reacción propuestos.
Equilibrio Termico

Este documento presenta los resultados de un experimento sobre el equilibrio térmico. Explica conceptos como calor, temperatura y energía interna, y cómo dos cuerpos alcanzan el equilibrio térmico cuando se igualan sus temperaturas tras un proceso de transferencia de calor del cuerpo más caliente al más frío. El experimento involucró calentar agua y medir el cambio de temperatura en el agua caliente y fría con el tiempo, observando cómo alcanzaron la misma temperatura una vez en equilibrio térmico.
Equivalente eléctrico del calor

En este experimento, se midió la energía eléctrica suministrada a una bobina calefactora sumergida en agua y la energía térmica absorbida por el agua. Se encontró que la energía térmica absorbida por el agua fue aproximadamente el 97.95% de la energía eléctrica suministrada, lo que indica que casi toda la energía eléctrica se convirtió en energía térmica.
ICECLASE 3

El documento explica el concepto de campo eléctrico. Introduce el campo eléctrico para evitar el problema de la acción a distancia. Define el campo eléctrico como la fuerza experimentada por una pequeña carga dividida por dicha carga. Presenta ejemplos de campos eléctricos en la naturaleza.
Problemas resueltos termodinmica

El documento presenta varios ejemplos resueltos sobre termodinámica de gases. El primer ejemplo calcula el trabajo realizado durante la transformación del estaño blanco a gris. El segundo ejemplo determina la lectura de un manómetro en un sistema de dos recipientes conectados con gases a diferentes temperaturas y volúmenes. El tercer ejemplo calcula la presión total, presiones parciales y fracción molar de oxígeno en una mezcla de dos gases.
Segunda ley de la termodinamica

Este documento resume los conceptos fundamentales de la segunda ley de la termodinámica. 1) Explica que los procesos naturales son irreversibles y aumentan el desorden. 2) Introduce el concepto de entropía como una medida cuantitativa del desorden. 3) Establece que la entropía total de un sistema aislado nunca disminuye en un proceso natural, solo aumenta o se mantiene constante.
1 gases ideales y reales

1) El documento discute los conceptos básicos de la termodinámica, incluyendo definiciones de sistema, energía, temperatura y presión.
2) Explica las leyes de los gases ideales de Boyle, Charles, Gay-Lussac y Avogadro y cómo se combinan en la ecuación del gas ideal.
3) Señala que los gases reales se desvían de la idealidad a altas presiones o bajas temperaturas debido a las fuerzas intermoleculares.
ecuación de van der wals

El documento presenta la ecuación de Van der Waals como una mejora a la ecuación de los gases ideales para describir el comportamiento de los gases reales a presiones moderadas y bajas temperaturas. Proporciona las constantes a y b para varios gases y presenta tres ejercicios para calcular presiones usando la ecuación de Van der Waals.
Formulario sobre la Primera Ley de la Termodinámica

Este documento presenta los conceptos fundamentales de la termodinámica, incluyendo las leyes de la termodinámica, trabajo en gases ideales, capacidades caloríficas, entalpía, termoquímica y procesos termodinámicos. Explica fórmulas clave como la primera ley de la termodinámica, trabajo en procesos isotérmicos, adiabáticos e isobáricos, y cambios en la entalpía y capacidades caloríficas para diferentes sustancias y procesos.
Laboratorio calor especifico

Este documento describe un experimento para determinar el calor específico de un sólido. Los estudiantes calentaron bloques de hierro y bronce y midieron la cantidad de calor transferido a agua en un calorímetro. Calculando el calor ganado y perdido, determinaron el calor específico de cada material. Los resultados estuvieron dentro del 5% del valor teórico. El documento también explica conceptos como calor específico, capacidad calorífica y diferencias en calores específicos de gases.
Ecuaciones de estado. Ejercicios resueltos

Este archivo contiene ejercicios sobre ecuaciones de estado (Van der Waals, Redlich-Kwong, Peng-Robinson) resueltos detalladamente.
Magnetismo. ing. Carlos Moreno. ESPOL

Este documento describe los fenómenos magnéticos y las fuerzas magnéticas. Explica que los imanes permanentes ejercen fuerzas entre sí y sobre fragmentos de hierro no magnetizados, y que cuando se pone una barra de hierro en contacto con un imán, la barra también se magnetiza. Además, introduce los conceptos de polos magnéticos, campo magnético, líneas de campo magnético, y cómo las cargas eléctricas en movimiento generan campos magnéticos.
Ejercicio de puntos extra

1) El documento explica cómo calcular teóricamente el calor de combustión estándar (ΔHoC) de un hidrocarburo a partir de los enlaces químicos que lo componen. 2) Se presenta un ejemplo del cálculo para el metano, obteniendo un ΔHoC teórico de 808 kJ/mol, con un error del 9.21% respecto al valor experimental. 3) También se muestra el cálculo para el butano, obteniendo un ΔHoC teórico de 2647 kJ/mol, con un error del 7.99%
3 segundaa ley

1) El documento describe conceptos fundamentales de la termodinámica como probabilidad, entropía y los ciclos de Carnot. 2) Explica que la entropía de un sistema aumenta en procesos irreversibles y permanece constante en procesos reversibles, dando lugar a la segunda ley de la termodinámica. 3) Introduce la tercera ley, que establece que la entropía de un sistema alcanza un valor mínimo de cero a una temperatura de cero grados kelvin.
Más contenido relacionado
La actualidad más candente
ECUACIÓN DE ESTADO DEL VIRIAL

Este documento describe las desviaciones de los gases reales de la ley de los gases ideales. Explica que a altas presiones y bajas temperaturas, especialmente cuando el gas está cerca de licuarse, los gases reales no se comportan como los ideales. Introduce el factor de compresión y la ecuación del virial, que relaciona la presión, volumen y temperatura mediante coeficientes viriales que miden las desviaciones del comportamiento ideal.
Termodinamica ejercicios resueltos

Este documento presenta una colección de problemas resueltos de termodinámica dividida en cinco capítulos. El autor, un estudiante de física, recopiló problemas de su asignatura de Termodinámica I y de libros de texto para ofrecer una guía de ayuda a otros estudiantes. Explica haber contrastado las soluciones y pide que le informen de errores para corregirlos. El documento carece de algunos temas pero podría ampliarse en el futuro.
Primera ley de la Termodinamica

La termodinámica estudia la transformación de energía térmica en mecánica y viceversa. La primera ley establece que la energía se conserva en cualquier proceso. El cambio en la energía interna de un sistema es igual al calor absorbido menos el trabajo realizado. Diferentes procesos incluyen isobáricos (presión constante), isotérmicos (temperatura constante), isocóricos (volumen constante) y adiabáticos (sin intercambio de calor).
Segunda Ley Y EntropíA

1. Se presenta un documento sobre la segunda ley de la termodinámica y la entropía. Incluye varios problemas resueltos sobre ciclos termodinámicos ideales, mezcla de sustancias y cálculos de trabajo y cambios de entropía.
2. Se pide calcular el rendimiento de varios motores térmicos ideales que siguen ciclos de procesos como expansión, compresión y calentamiento/enfriamiento.
3. Los problemas tratan conceptos fundamentales de la termodinámica como diagramas
Campo electrico distribuciones continuas de carga clase 4 TE

El documento describe el cálculo del campo eléctrico debido a distribuciones continuas de carga a través de la integración de la ley de Coulomb. Explica cómo calcular el campo eléctrico para cargas puntuales, líneas de carga, superficies y volúmenes. Luego, presenta varios problemas de aplicación que involucran el cálculo del campo eléctrico para barras cargadas, cilindros y objetos compuestos de cubos.
Lab Física B - Informe #12 (Ley de Boyle)

Este documento describe un experimento realizado para verificar la ley de Boyle usando aire a temperatura constante. Se midieron valores de presión y volumen del aire al variar la presión. Al graficar la presión contra el inverso del volumen, se obtuvo una pendiente constante que permitió calcular el número de moles de aire, el cual se mantuvo constante a pesar de los cambios en presión y volumen.
Ley de la difusión de graham

La Ley de la difusión de Graham establece que la velocidad de difusión y efusión de los gases es igual a la raíz cuadrada de sus masas molares, por lo que cuanto mayor sea la masa molecular de un gas, menor será su velocidad de difusión. La Ley de Fick describe matemáticamente la difusión como un proceso que depende del gradiente de concentración, el área de difusión y la difusividad de las especies involucradas.
Informe lab 2

Este informe describe un experimento de calorimetría para medir el calor específico de metales como el aluminio, el cobre y el hierro. Los estudiantes colocaron muestras de cada metal en agua hirviendo y luego las transfirieron a agua a temperatura ambiente para medir los cambios de temperatura. Esto les permitió calcular el calor cedido por cada metal y determinar su calor específico. También realizaron un experimento adicional con botellas de agua y frutiño para observar cómo se distribuye el cal
Etapas en una reacción catalítica.bueno

El documento describe los diferentes procesos involucrados en una reacción catalítica heterogénea, incluyendo la difusión de reactivos y productos, la adsorción, reacción y desorción. Se explican modelos cinéticos como Langmuir-Hinshelwood y Eley-Rideal para describir la velocidad de reacción. También se detalla el procedimiento para derivar ecuaciones de velocidad a partir de mecanismos de reacción propuestos.
Equilibrio Termico

Este documento presenta los resultados de un experimento sobre el equilibrio térmico. Explica conceptos como calor, temperatura y energía interna, y cómo dos cuerpos alcanzan el equilibrio térmico cuando se igualan sus temperaturas tras un proceso de transferencia de calor del cuerpo más caliente al más frío. El experimento involucró calentar agua y medir el cambio de temperatura en el agua caliente y fría con el tiempo, observando cómo alcanzaron la misma temperatura una vez en equilibrio térmico.
Equivalente eléctrico del calor

En este experimento, se midió la energía eléctrica suministrada a una bobina calefactora sumergida en agua y la energía térmica absorbida por el agua. Se encontró que la energía térmica absorbida por el agua fue aproximadamente el 97.95% de la energía eléctrica suministrada, lo que indica que casi toda la energía eléctrica se convirtió en energía térmica.
ICECLASE 3

El documento explica el concepto de campo eléctrico. Introduce el campo eléctrico para evitar el problema de la acción a distancia. Define el campo eléctrico como la fuerza experimentada por una pequeña carga dividida por dicha carga. Presenta ejemplos de campos eléctricos en la naturaleza.
Problemas resueltos termodinmica

El documento presenta varios ejemplos resueltos sobre termodinámica de gases. El primer ejemplo calcula el trabajo realizado durante la transformación del estaño blanco a gris. El segundo ejemplo determina la lectura de un manómetro en un sistema de dos recipientes conectados con gases a diferentes temperaturas y volúmenes. El tercer ejemplo calcula la presión total, presiones parciales y fracción molar de oxígeno en una mezcla de dos gases.
Segunda ley de la termodinamica

Este documento resume los conceptos fundamentales de la segunda ley de la termodinámica. 1) Explica que los procesos naturales son irreversibles y aumentan el desorden. 2) Introduce el concepto de entropía como una medida cuantitativa del desorden. 3) Establece que la entropía total de un sistema aislado nunca disminuye en un proceso natural, solo aumenta o se mantiene constante.
1 gases ideales y reales

1) El documento discute los conceptos básicos de la termodinámica, incluyendo definiciones de sistema, energía, temperatura y presión.
2) Explica las leyes de los gases ideales de Boyle, Charles, Gay-Lussac y Avogadro y cómo se combinan en la ecuación del gas ideal.
3) Señala que los gases reales se desvían de la idealidad a altas presiones o bajas temperaturas debido a las fuerzas intermoleculares.
ecuación de van der wals

El documento presenta la ecuación de Van der Waals como una mejora a la ecuación de los gases ideales para describir el comportamiento de los gases reales a presiones moderadas y bajas temperaturas. Proporciona las constantes a y b para varios gases y presenta tres ejercicios para calcular presiones usando la ecuación de Van der Waals.
Formulario sobre la Primera Ley de la Termodinámica

Este documento presenta los conceptos fundamentales de la termodinámica, incluyendo las leyes de la termodinámica, trabajo en gases ideales, capacidades caloríficas, entalpía, termoquímica y procesos termodinámicos. Explica fórmulas clave como la primera ley de la termodinámica, trabajo en procesos isotérmicos, adiabáticos e isobáricos, y cambios en la entalpía y capacidades caloríficas para diferentes sustancias y procesos.
Laboratorio calor especifico

Este documento describe un experimento para determinar el calor específico de un sólido. Los estudiantes calentaron bloques de hierro y bronce y midieron la cantidad de calor transferido a agua en un calorímetro. Calculando el calor ganado y perdido, determinaron el calor específico de cada material. Los resultados estuvieron dentro del 5% del valor teórico. El documento también explica conceptos como calor específico, capacidad calorífica y diferencias en calores específicos de gases.
Ecuaciones de estado. Ejercicios resueltos

Este archivo contiene ejercicios sobre ecuaciones de estado (Van der Waals, Redlich-Kwong, Peng-Robinson) resueltos detalladamente.
Magnetismo. ing. Carlos Moreno. ESPOL

Este documento describe los fenómenos magnéticos y las fuerzas magnéticas. Explica que los imanes permanentes ejercen fuerzas entre sí y sobre fragmentos de hierro no magnetizados, y que cuando se pone una barra de hierro en contacto con un imán, la barra también se magnetiza. Además, introduce los conceptos de polos magnéticos, campo magnético, líneas de campo magnético, y cómo las cargas eléctricas en movimiento generan campos magnéticos.
La actualidad más candente (20)
Campo electrico distribuciones continuas de carga clase 4 TE

Campo electrico distribuciones continuas de carga clase 4 TE
Formulario sobre la Primera Ley de la Termodinámica

Formulario sobre la Primera Ley de la Termodinámica
Destacado
Ejercicio de puntos extra

1) El documento explica cómo calcular teóricamente el calor de combustión estándar (ΔHoC) de un hidrocarburo a partir de los enlaces químicos que lo componen. 2) Se presenta un ejemplo del cálculo para el metano, obteniendo un ΔHoC teórico de 808 kJ/mol, con un error del 9.21% respecto al valor experimental. 3) También se muestra el cálculo para el butano, obteniendo un ΔHoC teórico de 2647 kJ/mol, con un error del 7.99%
3 segundaa ley

1) El documento describe conceptos fundamentales de la termodinámica como probabilidad, entropía y los ciclos de Carnot. 2) Explica que la entropía de un sistema aumenta en procesos irreversibles y permanece constante en procesos reversibles, dando lugar a la segunda ley de la termodinámica. 3) Introduce la tercera ley, que establece que la entropía de un sistema alcanza un valor mínimo de cero a una temperatura de cero grados kelvin.
7 color sobre la piel

El documento describe los componentes y características de varios productos cosméticos como lápiz labial, rímel y sombra de ojos. Explica que los lápices labiales contienen colorantes, pigmentos y aceites como base, mientras que los rímeles usan pigmentos como óxido férrico para lograr tonos negros. También cubre los pigmentos minerales y colorantes en polvo usados en maquillaje.
6 protección solar

El documento describe los efectos de la radiación solar en la piel humana y los mecanismos de defensa natural y artificial contra dicha radiación. Explica que la radiación ultravioleta del Sol puede ser dañina para la piel y causar quemaduras y cáncer, pero que la atmósfera y la capa de ozono filtran gran parte de esta radiación. También describe cómo la piel produce melanina para protegerse del Sol y los productos solares que ayudan a prevenir daños cutáneos.
9 tintes para el pelo

Este documento describe los diferentes tipos de tintes para el pelo, incluyendo tintes temporales, semipermanentes y permanentes. Explica que los tintes temporales usan colorantes de alto peso molecular que se depositan en la superficie del pelo, mientras que los semipermanentes y permanentes pueden penetrar más profundamente en el pelo. También describe los diferentes compuestos químicos utilizados en cada tipo de tinte y el proceso de coloración del pelo.
8 cosmética de uñas

Este documento describe la estructura y composición de las uñas, así como productos cosméticos comunes para el cuidado de uñas. Explica que las uñas están compuestas de matriz, eponiquio, paronniquio, hiponiquio y cuerpo ungueal. Luego describe ingredientes y formulaciones típicas para quitacutículas, limpiadores de uñas, endurecedores, blanqueadores, pulidores y barnices. Finalmente, explica que los removedores de barniz contienen disolventes para remover la capa protector
Reactividad de alcoholes 2

El documento describe diferentes métodos para convertir alcoholes en haluros de alquilo, incluyendo el uso de reactivos halógenos inorgánicos como el cloro, bromo y yodo, así como el uso de trifenilfosfina. También cubre la conversión de un alcohol a su correspondiente tosilato usando cloruro de tosilo.
Farma 7

Los alcaloides son metabolitos secundarios caracterizados por contener nitrógeno. Muchos tienen intensa actividad biológica y se derivan de aminoácidos, con estructuras heterocíclicas. Algunos alcaloides importantes son la morfina de la amapola, la cocaína de la coca, la estricnina de la nuez vómica, y la psilocibina del hongo de la corona de cristo.
Farma 5

El documento describe los aceites esenciales, definidos como mezclas aromáticas volátiles producidas por plantas. Explica que están compuestos principalmente de terpenoides y otros compuestos orgánicos. Se obtienen de plantas mediante destilación o expresión y se encuentran en hojas, flores y otros órganos. A continuación, presenta ejemplos detallados de diferentes aceites esenciales, incluyendo sus plantas de origen, componentes principales y usos.
Farma 4

Este documento describe la ruta metabólica del acetato-malonato que conduce a la formación de policétidos. Esta ruta inicia con la condensación de malonil coenzima A y acetil coenzima A para formar acetoacetil coenzima A. Luego, moléculas adicionales de malonil coenzima A se incorporan de forma secuencial mediante descarboxilación, elongando la cadena de carbonos del producto. De esta manera se forman diversos metabolitos como ácidos grasos, poliacetilenos y antibióticos mac
Ceramidas

Las ceramidas son lípidos naturales que forman parte de la barrera lipídica de la piel y ayudan a mantener su hidratación. Se sintetizan en los corpúsculos de Odland y forman bicapas lipídicas entre las células de la capa córnea. Con la edad y la exposición solar disminuye la producción de ceramidas, lo que reseca la piel. Muchos productos cosméticos incluyen ceramidas sintéticas para mejorar la hidratación y retrasar el envejec
Fps

El documento describe los diferentes tipos de radiación solar, los métodos para determinar el factor de protección solar de los protectores solares, y ofrece consejos sobre la elección y uso adecuado de protectores solares. Explica que existen cuatro métodos para determinar el factor de protección, siendo el método europeo COLIPA el más utilizado actualmente. Además, destaca la importancia de protegerse adecuadamente de la radiación UV dependiendo del fototipo y estado de la piel.
3 productos capilares

Este documento describe la importancia del cuidado del cabello y diferentes tipos de productos capilares como shampoos. Explica que el mercado de productos para el cuidado del cabello en México vale mil millones de dólares y está creciendo. También describe los componentes típicos de los shampoos como detergentes, reguladores de viscosidad y aditivos, y diferentes tipos de shampoos para tratar el cabello graso, seco, dañado o con piojos/caspa.
4 emulsiones

Una emulsión es una mezcla de dos líquidos inmiscibles como agua y aceite. Las emulsiones constan de dos fases, una dispersa y otra dispersante, separadas por una interfase. Las emulsiones normales son termodinámicamente inestables y requieren agitación para mantenerse. La estabilidad de una emulsión depende de factores como la tensión interfacial, la gravedad, las cargas eléctricas de las partículas y la temperatura.
Farma 6

Este documento describe la ruta metabólica del acetato-mevalonato que produce terpenoides en plantas. Explica la clasificación de terpenoides como monoterpenos, sesquiterpenos, diterpenos y otros. Luego describe varios ejemplos de terpenoides encontrados en plantas como el crisantemo, árnica, hierba de los dioses, tejo, nim y estevia.
Parabenos

Los parabenos son conservantes comunes en cosméticos y otros productos que han sido objeto de investigación sobre su posible relación con el cáncer. Mientras que un estudio de 2002 encontró parabenos en tumores de mama, no demostró que los causaran. La Unión Europea concluyó en 2010 que los parabenos tienen baja toxicidad y no causan cáncer, aunque las moléculas más grandes podrían tener efectos hormonales débiles. La UE permite el uso de parabenos en cosméticos con límites estrictos de concentra
5 desodorantes

El documento describe los componentes microbianos responsables del mal olor corporal y las opciones para resolver este problema, incluyendo desodorantes, antitranspirantes y antisépticos. Los antitranspirantes contienen sales de aluminio o cinc que reducen la producción de sudor al inflamar temporalmente los conductos sudoríparos, mientras que los antisépticos matan bacterias y los desodorantes enmascaran u ocultan los olores sin ser antisépticos.
Capitulo 15

La Unión Europea ha acordado un paquete de sanciones contra Rusia por su invasión de Ucrania. Las sanciones incluyen restricciones a las importaciones de productos rusos clave como el acero y limitar el acceso de los bancos rusos a los mercados financieros de la UE. Los líderes de la UE esperan que las sanciones aumenten la presión económica sobre Rusia y la disuadan de continuar su agresión contra Ucrania.
Reactividad de alcoholes 1

Este documento describe varias reacciones de oxidación de alcoholes utilizando diferentes reactivos como cromo (VI) en medio ácido o neutro y el reactivo de Swern. Proporciona instrucciones para representar los productos de las reacciones a través de fórmulas químicas.
Ejemplos de sea

La Unión Europea ha acordado un paquete de sanciones contra Rusia por su invasión de Ucrania. Las sanciones incluyen restricciones a las importaciones de bienes de Rusia, así como sanciones financieras contra bancos y funcionarios rusos. Los líderes de la UE esperan que estas medidas disuadan a Rusia de continuar su agresión militar contra Ucrania.
Destacado (20)
Similar a 2 primera ley
Trabajo y calor 2022-II (1).ppt

Este documento presenta conceptos básicos de termodinámica. Define un sistema termodinámico y sus variables, y explica las diferencias entre procesos reversibles e irreversibles. También introduce las nociones de trabajo y calor, y deriva fórmulas para calcular el trabajo en procesos de expansión y compresión de gases ideales. Finalmente, proporciona ejemplos numéricos para ilustrar el cálculo del trabajo en diferentes situaciones.
Modulo 1 seminario 1 fq con sugerencias

Este documento presenta la Primera Ley de la Termodinámica. Define conceptos clave como sistema, universo, trabajo y calor. Explica que la energía total de un sistema aislado se conserva y que los cambios en la energía interna de un sistema (ΔU) son iguales a la suma del calor (q) y el trabajo (w) transferidos. También cubre los diferentes tipos de trabajo y procesos termodinámicos como la expansión reversible e irreversible y la expansión adiabática.
Tema ii-primera-ley-de-la-termodinamica

Este documento resume los principales conceptos de la primera ley de la termodinámica. Explica que la primera ley establece la conservación de la energía en sistemas termodinámicos y que la variación de la energía interna de un sistema depende del calor transferido e trabajo realizado. También define conceptos como trabajo, calor, energía interna y describe procesos como isométricos, isobáricos e isotérmicos. Por último, explica la aplicación de la primera ley a dispositivos de ingeniería como toberas, tur
Tema ii-primera-ley-de-la-termodinamica

Este documento describe los principios fundamentales de la primera ley de la termodinámica. Explica que la primera ley establece la conservación de la energía en sistemas termodinámicos y que la variación de la energía interna de un sistema depende del calor transferido e trabajo realizado. También define conceptos clave como calor, trabajo, energía interna y procesos termodinámicos como isobáricos e isotérmicos.
Tema ii-primera-ley-de-la-termodinamica

Este documento describe los principios fundamentales de la primera ley de la termodinámica. Explica que la primera ley establece la conservación de la energía en sistemas termodinámicos y que la variación de la energía interna de un sistema depende del calor transferido e trabajo realizado. También define conceptos clave como calor, trabajo, energía interna y procesos termodinámicos como isobáricos e isotérmicos.
3 primera ley

Este documento describe las leyes fundamentales de la termodinámica, incluidas la Ley Cero, las escalas de temperatura y presión, y las definiciones de energía interna, trabajo y calor. Explica que la temperatura es una propiedad intensiva que permite determinar el equilibrio térmico, y que existe un cero absoluto de temperatura. También define las unidades de presión y las escalas de temperatura Kelvin y Celsius.
Resumen termoquimica dispositivas

Este documento presenta los conceptos fundamentales de la termoquímica. Introduce conceptos como sistema, calor, trabajo, energía interna, entalpía y las leyes de la termodinámica. Explica el primer principio de la termodinámica y cómo se relaciona el calor, el trabajo y la variación de energía interna de un sistema. También define conceptos como calor de reacción y entalpía de formación y cómo se pueden utilizar para predecir la espontaneidad de las reacciones químicas.
Primer Parcial T-2022.pptx

1. El documento describe los requisitos de asistencia, exámenes y evaluación para la clase de Termodinámica. Los estudiantes deben asistir a al menos el 70% de las clases teóricas y el 100% de las clases prácticas.
2. Habrá dos exámenes parciales que representarán el 35% de la calificación final, así como trabajos de laboratorio que representarán el 5%.
3. El examen final representará el 60% de la calificación final.
3

El documento describe el método de Clement y Desormes para determinar el coeficiente adiabático (γ) del aire. Se comprime el aire adiabáticamente de 5 a 7 cm y se miden las temperaturas y presiones iniciales y finales. Luego se expande el aire adiabáticamente y se vuelven a medir las temperaturas y presiones para verificar que el botellón regresa a su temperatura inicial. Este procedimiento se repite varias veces para determinar γ.
Termodinamica

Este documento describe los conceptos de energía interna y trabajo para gases ideales y no ideales. Explica que la energía interna de un gas depende de la temperatura y el volumen, y está compuesta por la energía cinética y potencial de sus moléculas. También describe procesos termodinámicos como adiabáticos, isobáricos e isotérmicos, y resume la Primera Ley de la Termodinámica.
Termodinamica2

Este documento describe los conceptos fundamentales de la energía interna y el trabajo para gases ideales y no ideales. Explica que la energía interna de un gas depende de la temperatura y el volumen, y que aumentos en la energía cinética se manifiestan como aumentos en la temperatura, mientras que aumentos en la energía potencial se manifiestan como aumentos en el volumen. También describe los diferentes tipos de procesos termodinámicos como adiabáticos, isobáricos e isotérmicos.
Practica 6 primera ley de la termodinamica

Este documento presenta un resumen de conceptos clave de termodinámica aplicados a un experimento de bombeo de agua. Explica brevemente la primera ley de la termodinámica, el trabajo, la energía interna y otros conceptos para analizar el flujo de masa de agua y la potencia de la bomba en el sistema de bombeo del laboratorio. El objetivo es aplicar los principios de conservación de masa y energía al sistema abierto.
Tema 4, principio generales de las máquinas

Este documento presenta información sobre el Sistema Internacional de Unidades (SI), incluyendo las magnitudes fundamentales, unidades derivadas y unidades adicionales. Explica conceptos como masa, peso, fuerza y diferencia entre ellos. También cubre unidades que no pertenecen al SI pero que aún se usan comúnmente.
Parctica #6 termo

Este documento presenta los detalles de una práctica de laboratorio sobre la conservación de la masa y la energía. Los estudiantes medirán el flujo de agua en un sistema de bombeo y calcularán la potencia de la bomba. Aplicarán la primera ley de la termodinámica y la ecuación de continuidad para determinar el flujo de masa en los puntos de entrada y salida del sistema. Luego analizarán dimensionalmente las ecuaciones derivadas para verificar que las unidades son consistentes.
Leyesdelatermodinmica 100805145529-phpapp02

1) El documento describe las leyes de la termodinámica y varios procesos termodinámicos como isotérmico, adiabático, isobárico e isovolumétrico. 2) También explica conceptos como calor, trabajo, energía interna y máquinas térmicas. 3) La segunda ley establece que el calor nunca fluye espontáneamente de un cuerpo frío a uno más caliente.
Termodinamica tecnica problemas - garcía

El documento presenta un capítulo sobre la aplicación del primer principio de la termodinámica a sistemas cerrados de gases. Introduce conceptos teóricos como el balance de energía, trabajo y calor. Luego presenta varios problemas tipo relacionados con sistemas de gases ideales en procesos adiabáticos, calculando variables como masa, temperatura, volumen y presión.
Termoquímica

Este documento presenta conceptos fundamentales de termoquímica, incluyendo: (1) El primer principio de la termodinámica, que establece que la energía total de un sistema y su entorno se mantiene constante; (2) La entalpía (H), una función de estado relacionada con el calor y el trabajo en procesos isobáricos; y (3) Las entalpías de reacción y formación, que miden los cambios de entalpía en reacciones químicas bajo condiciones estándar.
Leyes de la termodinámica 

1) El documento describe las leyes de la termodinámica y varios procesos termodinámicos como isotérmicos, adiabáticos e isobáricos. 2) Explica que el calor es una transferencia de energía debido a una diferencia de temperatura mientras que el trabajo no depende de la temperatura. 3) Las leyes de la termodinámica establecen que la energía se conserva y que el calor solo fluye de los cuerpos calientes a los frios.
Primera ley de la termodinamica

El documento presenta los conceptos fundamentales de la Primera Ley de la Termodinámica. Explica que esta ley establece que la variación de la energía interna de un sistema es igual al calor agregado menos el trabajo realizado. También define conceptos clave como sistema, entorno, trabajo, calor y energía interna.
Termo

Este documento introduce los conceptos fundamentales de la termodinámica, incluyendo la energía, el trabajo, el calor y la temperatura. Explica que la termodinámica estudia la energía y sus transformaciones, las cuales están sujetas a leyes generales impuestas por la naturaleza. También define conceptos clave como sistema, propiedades intensivas y extensivas, y estados de equilibrio.
Similar a 2 primera ley (20)
Más de Rodolfo Alvarez Manzo
Sch indol2

La síntesis de indoles de Fischer convierte aldehidos o cetonas en indoles mediante la reacción con fenilhidrazina. Cuando se usan cetonas asimétricas, se forma una mezcla de productos, pero cuando la cetona tiene un solo grupo con dos átomos de hidrógeno en posición alfa, solo se forma un producto. Los aldehidos y algunas cetonas asimétricas especiales dan lugar a un único indol.
Ia bo

O documento descreve o processo de síntese do acetil-CoA a partir do ácido pirúvico, Mg2+ e CoA. O processo envolve a condensação do ácido pirúvico com o CoA, liberando dióxido de carbono e formando o intermediário acil-CoA. Em seguida, ocorre a hidrólise do grupo fosfato do acil-CoA, formando acetil-CoA, pirofosfato e AMP.
Espectro 1

El documento presenta 6 espectros infrarrojos. El Espectro 1 corresponde a un alcano con fórmula CnH2n+2. El Espectro 2 muestra una función carbonilo C=O y un anillo aromático. El Espectro 3 identifica un éster y un anillo aromático monosustituido. El Espectro 4 sugiere la presencia de un ácido carboxílico y un anillo aromático con un cloro sustituyente. Los Espectros 5 y 6 muestran aminas primarias, isopropilo y ter-
Pqi pizarrones

Este documento presenta las fórmulas y conceptos fundamentales de la espectroscopia infrarroja. Explica que la energía de un fotón infrarrojo depende de la constante de Planck, la frecuencia y la longitud de onda de la radiación. También describe que cada grupo funcional absorbe radiación infrarroja a una frecuencia distinta, lo que permite identificar compuestos orgánicos mediante su espectro infrarrojo único. Finalmente, indica que la escala de números de onda se mide en cm-1 y que se requieren al
Pizarrones sch

1) Se describe un método de síntesis de anillos de cinco miembros con un heteroátomo a partir de cascarillas de trigo. Las cascarillas se hidrolizan en medio ácido para formar furfural, el cual puede oxidarse a ácido furoico y descarboxilarse para producir furano.
2) Se explican varios métodos sintéticos como la reacción de Paal-Knorr, el uso de ácido polifosfórico y pentóxido de fósforo como agentes deshidratantes, y las reacc
Apuntes de sch 1.0

Este documento presenta información sobre la síntesis de compuestos heterocíclicos de cinco miembros con un heteroátomo, incluyendo furanos, pirroles y tiofenos. Describe los métodos de síntesis de Paal-Knorr para furanos y el método de Hinsberg para tiofenos. También menciona compuestos heterocíclicos fusionados con benceno como el indol y el benzo[b]furano, que se encuentran en medicamentos.
Plan de-trabajo-para-lca

Este documento presenta el plan de trabajo para el Laboratorio de Ciencias Ambientales para abril de 2020. No habrá tareas durante las vacaciones. La próxima sesión será el 20 de abril y consistirá en un seminario en línea sobre metabolismo secundario. El informe del laboratorio del 30 de marzo se entregará el 27 de abril. Se deben explicar los resultados de varias prácticas de laboratorio. Cualquier duda se puede enviar por correo electrónico o Facebook.
Proteinas tcoa copia

El documento describe los procesos de desnaturalización de proteínas y deterioro de biomoléculas. La desnaturalización implica la pérdida de la estructura ordenada de la proteína debido a cambios en la conformación causados por factores térmicos, químicos, de pH o mecánicos. Esto resulta en la pérdida de funciones de la proteína. El deterioro de lípidos puede ocurrir por hidrólisis o oxidación, generando ácidos grasos o peróxidos respectivamente.
Qo2 unam 1

Este documento describe varias reacciones químicas de alcoholes y haluros de alquilo, incluyendo su conversión a haluros de alquilo mediante HCl o cloruro de tionilo, su oxidación a aldehídos, cetonas o ácidos carboxílicos usando reactivos de cromo, y su conversión a ésteres o éteres. También resume métodos para sintetizar aminas como la reacción de Gabriel y reducciones con litio aluminio hidruro.
Pqi uvm 1 infrarrojo

Este documento presenta una tabla de absorciones de grupos funcionales de moléculas orgánicas en espectroscopía de infrarrojo. La tabla incluye las absorciones características de hidrocarburos alifáticos y aromáticos, alcoholes, fenoles, éteres, aminas, aldehidos, cetonas, ácidos carboxílicos y sus derivados. El documento fue escrito por el Dr. Rodolfo Álvarez para el Laboratorio de Procesos Químicos Instrumentales y proporciona inform
Qo2 unam 3

Los halogenuros de alquilo pueden convertirse en una gran cantidad de derivados a través de reacciones de sustitución debido a que los halógenos forman uniones débiles con el carbono y son fácilmente removibles o intercambiables. Las reacciones de Finkelstein donde un halógeno sustituye a otro y la hidrólisis de nitrilos son procesos mediante los cuales los halogenuros de alquilo pueden transformarse. Los halogenuros de alquilo se usan comúnmente como intermediarios sintétic
Qo2 unam 2

Este documento describe diferentes reacciones químicas como la conversión a ésteres y éteres. También explica por qué el tetrahidrofurano es más estable que el oxetano debido a las tensiones angulares en los enlaces de carbono sp3 en el oxetano. Finalmente, analiza las cinéticas de las reacciones de ciclación en estos compuestos debido a las tensiones estructurales.
Qo2 unam 1

Este documento describe las reacciones de los alcoholes con diferentes reactivos químicos para su conversión. Explica que los alcoholes pueden ser convertidos a halogenuros de alquilo mediante la reacción con HCl o SOCl2, o pueden ser oxidados a aldehidos, cetonas o ácidos carboxílicos usando reactivos como PCC, Jones o CrO3/H2SO4 dependiendo del tipo de alcohol. También menciona reactivos como PCl3, PBr3 o P(C6H5)3 que se usan para
Manual de ciencias ambientales

Este documento presenta el protocolo para dos prácticas de laboratorio sobre el análisis cuantitativo de muestras. La primera práctica describe el método para determinar el contenido de vitamina C en jugo de naranja mediante titulación con 2,6-diclorofenolindofenol. La segunda práctica explica el procedimiento para extraer y cuantificar cafeína en refrescos usando espectrofotometría. Ambas prácticas aplican conceptos como molaridad, normalidad y curvas de calibración para obt
Cadena respiratoria 2020

Este documento describe los procesos de digestión, absorción y metabolismo de los nutrientes en el cuerpo humano. Explica cómo los nutrientes son degradados a moléculas más pequeñas durante la digestión y absorbidos en la sangre. Luego, durante el metabolismo estas moléculas son usadas para producir energía a través de rutas catabólicas en la mitocondria o reconstruidas en macromoléculas a través de rutas anabólicas. También describe la cadena de transporte de electrones y fosforilación oxidativa en la memb
Primer examen parcial pqi

El documento describe los procedimientos para un examen de laboratorio que incluye la estandarización de una solución de permanganato de potasio usando oxalato de sodio y la determinación de la concentración de bisulfito de sodio y peróxido de hidrógeno en muestras mediante valoraciones redox con la solución estandarizada.
Carbohidratos

Este documento describe varios experimentos realizados para identificar carbohidratos. Se utilizaron métodos como la obtención de osazonas, las pruebas de Tollens y Fehling, y el análisis de Seliwanoff para distinguir entre monosacáridos como la glucosa y la fructosa. También se usó el método de la antrona para medir los azúcares totales. Los resultados mostraron que la glucosa, la fructosa y la maltosa son azúcares reductores, mientras que la sacarosa no lo es.
Cafeina

Este documento describe tres protocolos para determinar la cafeína en refrescos mediante análisis cuantitativo. Primero, se lleva a cabo una extracción de la cafeína del refresco usando diclorometano como solvente orgánico y carbonato de sodio para formar la sal soluble de la cafeína. Luego, se mide la absorbancia de las muestras extraídas y se compara con una curva patrón para cuantificar la cafeína. Finalmente, los resultados de dos equipos se presentan, mostrando concentraciones similares de
Más de Rodolfo Alvarez Manzo (20)
Último
MATERIAL ESCOLAR 2024-2025 3 AÑOS CEIP SAN CRISTÓBAL

MATERIAL ESCOLAR 2024-2025 3 AÑOS CEIP SAN CRISTÓBAL
Presentación simple corporativa degradado en violeta blanco.pdf

Presentación proyecto solución aforo carnaval
Gracias papá voz mujer_letra y acordes de guitarra.pdf

Puedes encontrar el video y el archivo para descargar en mi blog:
https://labitacoradeann.blogspot.com/2024/06/gracias-papa.html
Mi Comunidad En El Sector Monterrey-Poste Blanco

Está Diapositiva, Está Hecha Para Las Personas Que Quieran Conocer Un Poco De Mi Espacio Personal
REGIMÉN ACADÉMICO PARA LA EDUCACIÓN SECUNDARIA - RESOC-2024-1650-GDEBA-DGC...

Regimen Académico para la escuela secundaria
La filosofía presocrática y los filosofos más relvantes del periodo.

clase de la filosofía presocrática.
Compartir p4s.co Pitch Hackathon Template Plantilla final.pptx-2.pdf

En la ciudad de Pasto, estamos revolucionando el acceso a microcréditos y la formalización de microempresarios informales con nuestra aplicación CrediAvanza. Nuestro objetivo es empoderar a los emprendedores locales proporcionándoles una plataforma integral que facilite el acceso a servicios financieros y asesoría profesional.
ANALISIS CRITICO DEL PENSAMIENTO COLONIAL Y DESCOLONIZACION

ES UN ANALISIS DE LA REALIDAD BOLIVIANA EN LA ETAPA DE DESCOLONIZACION DE BOLIVIA, QUE SE DA MEDIANTE INSURGENCIAS INDIGENAS HASTA EL SIGLO XXI
Business Plan -rAIces - Agro Business Tech

Innovación y transparencia se unen en un nuevo modelo de negocio para transformar la economia popular agraria en una agroindustria. Facilitamos el acceso a recursos crediticios, mejoramos la calidad de los productos y cultivamos un futuro agrícola eficiente y sostenible con tecnología inteligente.
Último (20)
MATERIAL ESCOLAR 2024-2025 3 AÑOS CEIP SAN CRISTÓBAL

MATERIAL ESCOLAR 2024-2025 3 AÑOS CEIP SAN CRISTÓBAL
Presentación simple corporativa degradado en violeta blanco.pdf

Presentación simple corporativa degradado en violeta blanco.pdf
Gracias papá voz mujer_letra y acordes de guitarra.pdf

Gracias papá voz mujer_letra y acordes de guitarra.pdf
REGIMÉN ACADÉMICO PARA LA EDUCACIÓN SECUNDARIA - RESOC-2024-1650-GDEBA-DGC...

REGIMÉN ACADÉMICO PARA LA EDUCACIÓN SECUNDARIA - RESOC-2024-1650-GDEBA-DGC...
Presentación de proyecto en acuarela moderna verde.pdf

Presentación de proyecto en acuarela moderna verde.pdf
La filosofía presocrática y los filosofos más relvantes del periodo.

La filosofía presocrática y los filosofos más relvantes del periodo.
Compartir p4s.co Pitch Hackathon Template Plantilla final.pptx-2.pdf

Compartir p4s.co Pitch Hackathon Template Plantilla final.pptx-2.pdf
Evaluacion-Formativa-Nueva Escuela Mexicana NEM-ok.pdf

Evaluacion-Formativa-Nueva Escuela Mexicana NEM-ok.pdf
1.- manual-para-la-creacion-33-dias-de-manifestacion-ulises-sampe.pdf

1.- manual-para-la-creacion-33-dias-de-manifestacion-ulises-sampe.pdf
ANALISIS CRITICO DEL PENSAMIENTO COLONIAL Y DESCOLONIZACION

ANALISIS CRITICO DEL PENSAMIENTO COLONIAL Y DESCOLONIZACION
Independencia de Chile, Causas internas y externas

Independencia de Chile, Causas internas y externas
2 primera ley
- 1. Primera Ley de la Termodinámica
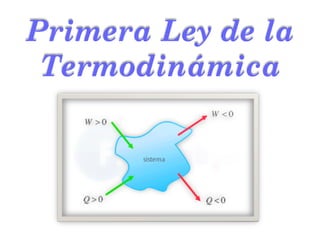
- 2. Componentes fundamentales. La Primera Ley de la Termodinámica es uno de los principios fundamentales de la Naturaleza y puede resumirse de una manera muy simple: entradas iguales a salidas. Al día de hoy, no existe absolutamente nada que haya podido cuestionar su observancia. Para definirla rigurosamente es necesario tener clara la definición y los alcances de algunos conceptos fundamentales involucrados en su estudio que discutiremos en esta sección: Trabajo (W), Calor (Q), Energía Interna (U) y Entalpía (H).
- 3. El trabajo en Termodinámica posee un significado idéntico en lo conceptual al que se desarrolla en los cursos de Física (fuerza por distancia): con él, algo cambia en un sistema. Ejemplos de tipos de trabajo que resultan de interés en Termodinámica son: el que se desarrolla sobre la superficie de un líquido (γdA, γ = tensión superficial, A = área), en una batería (Edq, E = voltaje, q = carga eléctrica) o el que experimenta un gas en expansión al interior de un cilindro (PdV), etc. Centraremos nuestra atención en este último. TRABAJO, W.
- 4. Considera un experimento imaginario (al estilo Einstein) donde un gas contenido dentro de un cilindro se expande isotérmicamente desarrollando un cierto trabajo W gracias al cual se logra que una pesa con peso mg colocada sobre un pistón sin peso ascienda a la posición final que se indica. Expansión isotérmica de un gas. P1, V1, T P2, V2, T mg mg pistón
- 5. Todo lo anterior transcurre asumiendo que la presión atmosférica exterior es igual a cero y que el pistón no ejerce fricción sobre las paredes del cilindro. Bajo tales condiciones, el gas dentro del cilindro deja de expandirse hasta que la presión que ejerce iguala a la del exterior, mg/A. Expansión isotérmica de un gas. P1, V1, T P2, V2, T mg mg
- 6. donde Pop = presión que se opone a la expansión del gas = peso de la pesa (mg) / área del pistón (A); Δx = distancia que se mueve en vertical el pistón hasta que las presiones interior y exterior se igualan. Expansión isotérmica de un gas. P1, V1, T P2, V2, T mg mg Pop = mg A Definamos a la p r e s i ó n d e l exterior como se muestra en la Ecuación 1: u
- 7. W = trabajo realizado por el sistema; F = fuerza; d = distancia. El signo (–) indica que el sistema está haciendo trabajo sobre los alrededores. Expansión isotérmica de un gas. P1, V1, T P2, V2, T mg mg Definamos ahora a l t r a b a j o m e d i a n t e l a Ecuación 2: W = – F x d W = – mg x Δx v
- 8. Pero A x Δx = ΔV = incremento de volumen que ganó el gas en su trabajo de expansión. Con esto llegamos a la Ecuación 3 que define el trabajo desarrollado durante la expansión del gas: W = – Pop ΔV Expansión isotérmica de un gas. P1, V1, T P2, V2, T mg mg Al combinar las ecuaciones 1 y 2 igualando ambas a mg se obtiene: W = – Pop x A x Δx w
- 9. Expansión isotérmica de un gas. P V P1,V1 P2,V2 La magnitud del trabajo desarrollado por el gas queda expresada a partir de la Ecuación 3, pero puede expresarse también de manera gráfica: da- do que W está en función de Pop y que, al final del experimento, Pop = P2, el área en a z u l r e p r e s e n t a g r á f i c a m e n t e a l trabajo: advierte que las aristas de este rectángulo resultan ser (P2) y (V2–V1).
- 10. Expansión isotérmica de un gas. P V P1,V1 P2,V2 La expansión del gas efectuada de esta manera, en una sola etapa, procede en un tiempo finito (el menor posible) dado que se trata de un sistema que no se encuentra en equilibrio y que no se d e t i e n e h a s t a a l c a n z a r l o . A u n p r o c e s o c o n t a l e s características se le define como un proceso termodinámicamen- te irreversible.
- 11. Expansión isotérmica de un gas. ¿A que se le se le puede denominar entonces proceso reversible? Un proceso reversible es aquél al que se le impone (teóricamente) que proceda a través de una serie de cambios infinitesimales sucesivos (en este caso, expansiones de un gas) entre dos estados, lo que implica disponer para él de un tiempo infinito para que pueda completarse. A partir de esto, queda claro que los procesos puramente reversibles no existen, no obstante, resulta trascendente examinar los resultados que se obtendrían con respecto a la producción de trabajo si uno de ellos pudiese tener lugar.
- 12. Expansión isotérmica de un gas. Primer punto. Para entender que ocurre en el caso de la expansión reversible de un gas, consideremos al mismo sistema que analizamos antes, salvo que ahora al inicio, en lugar una única pesa mg, sobre el pistón se encontrará colocada una cantidad infinita de pequeñas pesas que ejercen en conjunto una presión sobre el gas tal que igualan el valor de P1. De esta manera, y a diferencia del proceso anterior en donde asumimos que desde un principio el gas se expande espontáneamente, ahora consideraremos que no podrá hacerlo hasta que no sea removida la primera de esas pequeñas pesas infinitesimales.
- 13. Expansión isotérmica de un gas. Segundo punto. Suponte que ahora remueves la primera de las pesas y a continuación la siguiente, y a s í s u c e s i v a m e n t e . A l m o d i f i c a r s e infintesimalmente la presión externa conforme las pesas se remueven, nuestro gas dentro del cilindro comenzará a expandirse aumentando en dV su volumen en cada una de las etapas. Esta sucesión infinita de etapas continuará hasta llegar al estado final (idéntico al del primer ejemplo), de tal manera que si queremos determinar el trabajo total desarrollado por el sistema, una buena estrategia a seguir sería calcular el trabajo desarrollado en cada una de estas etapas y, al final, realizar una sumatoria de todos estos valores.
- 14. Expansión isotérmica de un gas. Tercer punto. Para expresar formalmente esta sumatoria, será necesario plantear una expresión que incluya una integral definida para calcular el trabajo. Ésta se muestra en la Ecuación 4. A diferencia de la expansión en una etapa, la remoción continuada de las pesas infinitesimales estará asociada a una variación apenas mínima en las posiciones de equilibrio de dos etapas consecutivas, lo que define a un proceso reversible. V2 V1 W = – PopdV x
- 15. Expansión isotérmica de un gas. Cuarto punto. ¡Cuidado!: la Pop en este caso, estrictamente hablando, no fue constante durante todo el experimento, por lo que la expresión anterior no es completamente válida. No obstante, hagamos lo siguiente: en cada cambio, Pin – Pop = dP (Pin = presión del gas; dP = cambio de presión infinitesimal originado por la remoción de cada pesa). Despejando Pop obtenemos Pop = Pin – dP, expresión gracias a la cual podemos transformar la Ecuación 4 en: W = – (Pin – dP) dV V2 V1
- 16. Expansión isotérmica de un gas. Cuarto punto. Y como el producto de dos diferenciales se puede aproximar a cero, la ecuación se reduce a: W = – Pin dV Pin depende sólo de nuestro gas (y su comportamiento está en función de V2 y V1). Es más: si asumimos que nuestro gas es ideal (para simplificar nuestra discusión, mas nunca para invalidarla) llegamos a: W = – dV V2 V1 nRT V V2 V1
- 17. Expansión isotérmica de un gas. Quinto punto. Finalmente, luego de integrar, se obtiene el trabajo realizado por un sistema reversible (Ecuación 5). W = – nRT ln Una forma alterna para esta ecuación es la siguiente: W = – nRT ln P1 P2 V2 V1 y y
- 18. P P1,V1 V P2,V2 Expansión isotérmica de un gas. La diferencia entre las dos expansiones es que, al efectuar el proceso de manera reversible, el trabajo que se desarrolla es máximo: ahora W corresponde al área mostrada en azul en el diagrama. Como puedes ver, la cantidad de W que puede obtenerse de este tipo de procesos es óptima… no obstante, para que este proceso pueda tener lugar, requerirías de un tiempo infinito.
- 19. Expansión isotérmica de un gas. Los procesos a tiempo infinito no pueden tener lugar en la realidad. Sin embargo, ahora ya tienes p r e s e n t e u n a i d e a fundamental de lo que persigue la Ingeniería en términos termodinámicos: que la la optimización de los procesos que son de su interés busca para ellos tendencias de optimización reversibles.
- 20. ¤ 1 julio (J, joule, SI!) = 1 Nm ¤ 1 litro-atmósfera (L-atm) = 101.325 J ¤ 1 ergio (erg, dina-cm) = 1 x 10-7 J ¤ 1 caloría = 4.184 J ¤ 1 british thermal unit (BTU) = 1055.06 J ¤ 1 kilowatt-hora = 3.6 x 106 J ¤ 1 libra fuerza-pie (lb-ft) = 1.355 J Unidades importantes de W.
- 21. W no es una función de estado. A partir de lo revisado, debe ser claro que la magnitud de W depende de la trayectoria que haya seguido un experimento y que no es una función de estado (no se calculó un “–ΔW” ni puede afirmarse que un sistema posea una cierta cantidad de trabajo). En contraste, la magnitud del cambio en una función de estado sólo depende de los estados inicial y final del sistema: el incremento en volumen ΔV en ambos casos analizados, a pesar de que uno fue reversible y el otro irreversible y siguieron trayectorias disímbolas, fue idéntico (se empleó el mismo equipo y se le permitió recorrer al pistón la misma distancia Δx.
- 22. El calor es la transferencia de energía entre dos cuerpos que se encuentran a diferente temperatura. Al igual que W, sólo aparece en el contorno del sistema y no es una propiedad del sistema ni una función de estado: sólo se trata de una medida de la transferencia de energía cuyos cambios dependen de la trayectoria seguida en ese cambio de estado e igualmente sólo puede definirse a partir de un proceso. CALOR, Q.
- 23. El cambio de energía Q transferido desde los alrededores al sistema se cuantifica a partir de Q = msΔT donde m = masa de la muestra; s = calor específico de una sustancia = cantidad de calor que hay que suministrar a una unidad de masa de una sustancia o sistema termodinámico para elevar su temperatura en una unidad. Nuevamente, si el sistema trasnfiere calor, Q poseerá un valor negativo. Cuantificación de Q.
- 24. La energía interna es la energía total de un sistema asociada a la suma de las energías potencial y cinética de todas las moléculas que lo componen (energía rotacional, vibracional, traslacional, etc.). Es una función de estado. ENERGÍA INTERNA, U.
- 25. PRIMERA LEY DE LA TERMODINÁMICA. La Primera Ley de la Termodinámica establece que la energía puede ser convertida de una forma a otra pero jamás creada o destruida, o lo que es lo mismo, la energía del Universo permanece siempre constante.
