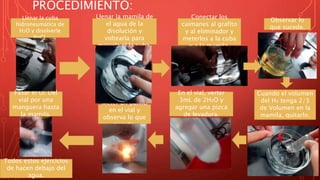
Este documento describe un experimento de laboratorio para sintetizar moléculas de agua a partir de hidrógeno y oxígeno gaseosos. Los estudiantes utilizaron electrolisis para obtener los gases y luego los combinaron mediante una reacción química de síntesis verificada por una pequeña explosión al exponer la mezcla a una llama. El objetivo del experimento fue cumplido al sintetizarse con éxito moléculas de agua a partir de las sustancias puras iniciales.