Incrustar presentación
Descargado 23 veces








![Un ácido de Brönsted-Lowry
se define como
Cualquier sustancia que tenga la
capacidad de perder, o “donar un protón”
o hidrogenión [H+].](https://image.slidesharecdn.com/teorascido-base-141125163952-conversion-gate01/85/Teor-as-icido-base-10-320.jpg)
![Una base de Brönsted-Lowry
se define como:
Una sustancia capaz a ganar o “aceptar
un protón” o hidrogenión [H+].](https://image.slidesharecdn.com/teorascido-base-141125163952-conversion-gate01/85/Teor-as-icido-base-11-320.jpg)
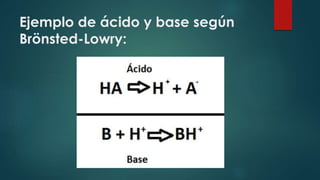
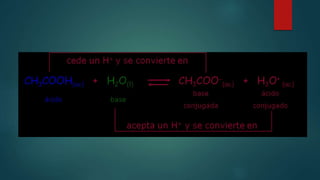
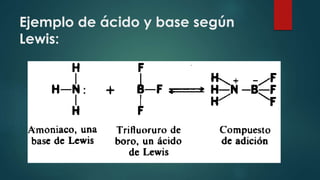
El documento resume tres teorías principales de ácidos y bases: 1) Según Arrhenius, los ácidos contienen hidrógeno y producen iones hidrógeno en agua, mientras que las bases producen iones hidróxido; 2) Lewis definió ácidos como sustancias aceptoras de electrones y bases como donantes; 3) Brönsted-Lowry define ácidos como donantes de protones e hidrogeniones y bases como aceptoras.









![Un ácido de Brönsted-Lowry
se define como
Cualquier sustancia que tenga la
capacidad de perder, o “donar un protón”
o hidrogenión [H+].](https://image.slidesharecdn.com/teorascido-base-141125163952-conversion-gate01/85/Teor-as-icido-base-10-320.jpg)
![Una base de Brönsted-Lowry
se define como:
Una sustancia capaz a ganar o “aceptar
un protón” o hidrogenión [H+].](https://image.slidesharecdn.com/teorascido-base-141125163952-conversion-gate01/85/Teor-as-icido-base-11-320.jpg)

