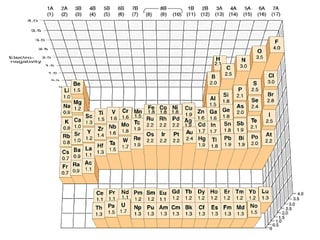
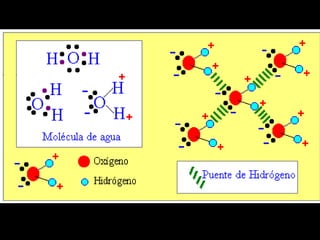
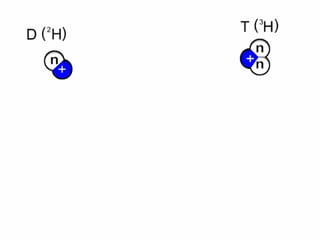
Este documento trata sobre los diferentes tipos de enlaces químicos, incluyendo enlaces iónicos, covalentes y metálicos. También describe las interacciones intermoleculares como enlaces dipolo-dipolo, puente de hidrógeno y fuerzas de Van der Waals. Además, explica conceptos como isótopos, número atómico y número de masa.