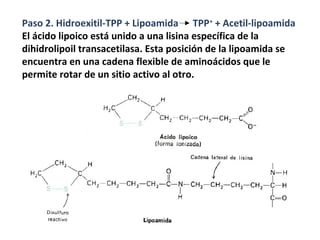
1) La conversión del piruvato en acetil-CoA ocurre en 4 etapas y es catalizada por el complejo enzimático piruvato deshidrogenasa. 2) El piruvato se descarboxila formando acetil-TPP, que luego se transfiere a la lipoamida formando acetil-lipoamida. 3) El acetilo se transfiere luego a CoA formando acetil-CoA en la última etapa.






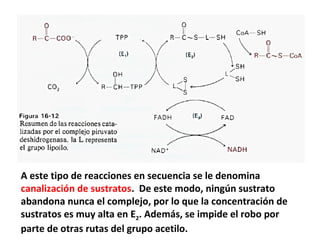


![Una gran cantidad de combustible inhibe la descarboxilación
de piruvato, que se acumula en el exterior de la mitocondria e
inhibe, también alostéricamente, a la glucólisis. A la par, se da
un incremento de ATP, de ácidos grasos que acumulan energía
y la relación [NADH]/[NAD+
] es alta. La demanda de acetil-CoA
es, por lo tanto, lo que permite la descarboxilación del
piruvato. Esta demanda se manifiesta como un aumento en la
concentraciones de AMP, CoA, NAD+
y Ca+2
.](https://image.slidesharecdn.com/14-160707004223/85/14-conversion-de-piruvato-en-acetil-coa-11-320.jpg)




