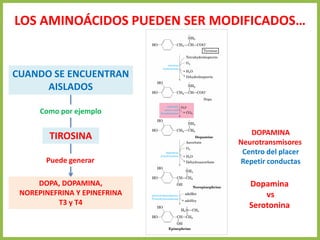
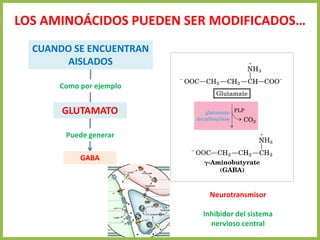
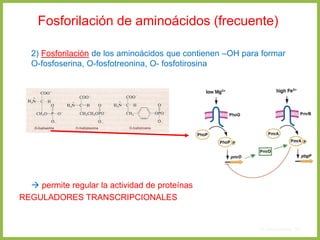
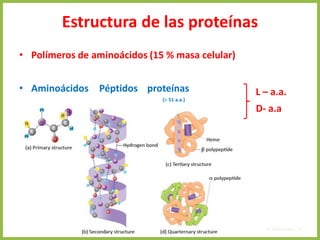
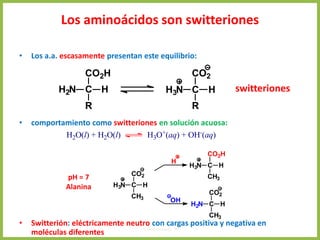
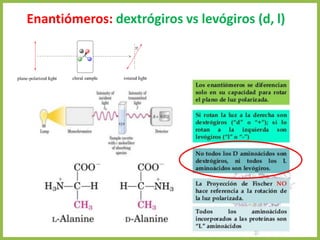
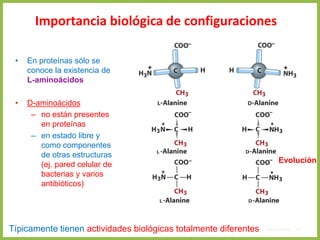
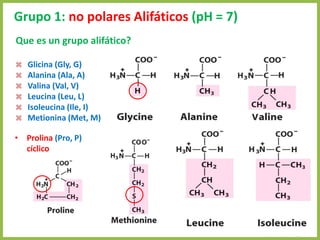
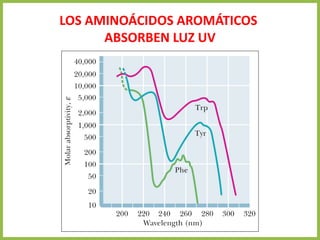
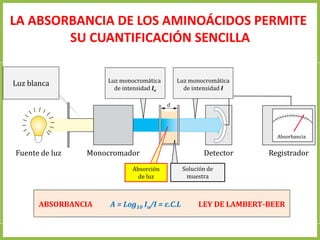
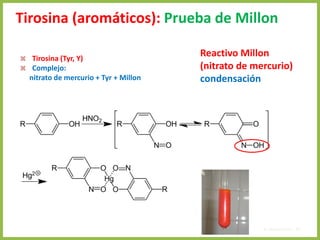
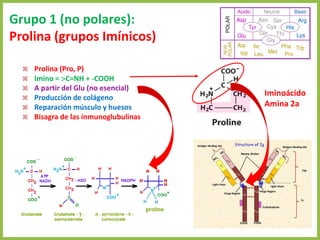
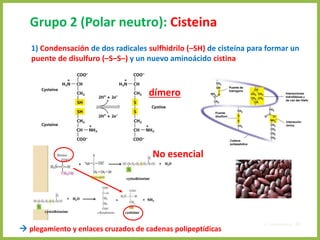
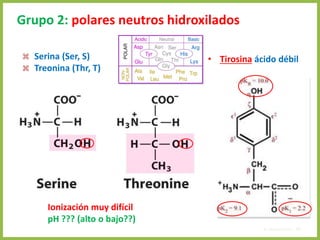
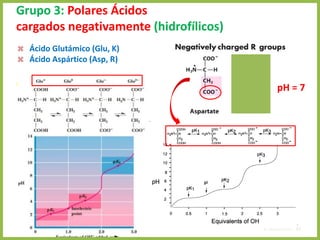
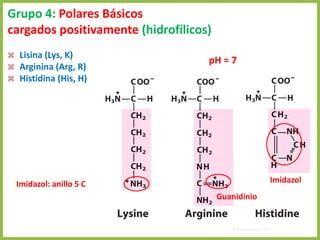
El documento describe las características estructurales y químicas de los aminoácidos. Explica que los aminoácidos son los bloques de construcción de las proteínas y están formados por un carbono alfa unido a un grupo carboxilo, un grupo amino y una cadena lateral variable. Los aminoácidos existen como estereoisómeros L y D, pero solo los aminoácidos L se incorporan a las proteínas. También clasifica los aminoácidos en cuatro grupos basados en las propiedades de sus cadenas laterales y explica conceptos como el



































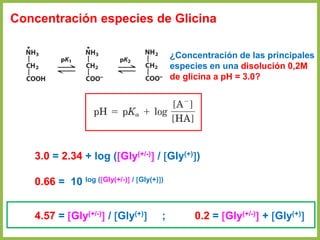
![Proporción de especies de a.a en solución
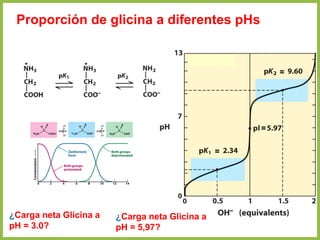
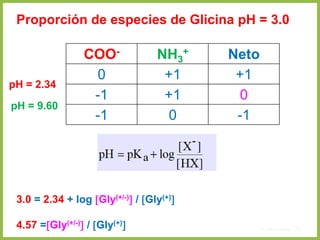
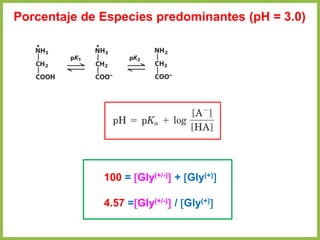
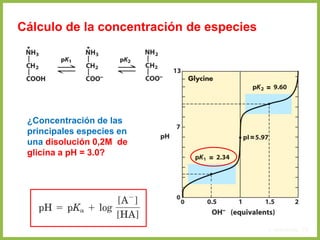
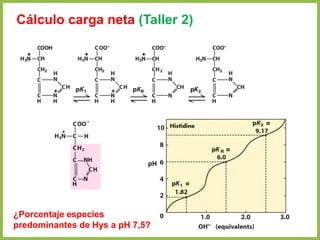
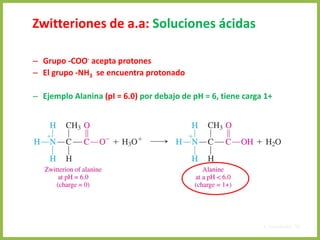
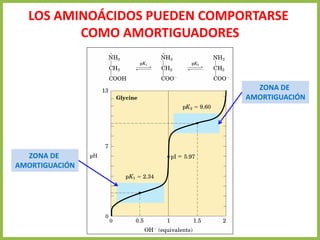
• En cualquier otro punto de la curva diferente a pI, la carga neta de los aminoácidos
depende de las concentraciones relativas de las dos sustancias en equilibrio
• Esta carga neta a otro pH se evalúa mediante la ecuación de Henderson-
Hasselbalch
4. Aminoácidos 74
[A-]
[HA]](https://image.slidesharecdn.com/4-220820182252-b7fdb04c/85/4-Aminoacidos_V6-pdf-52-320.jpg)