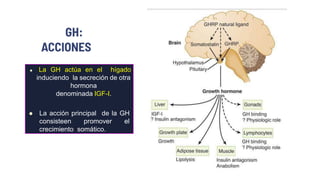
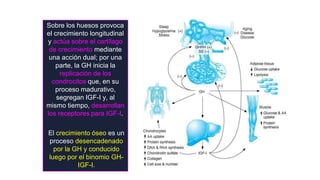
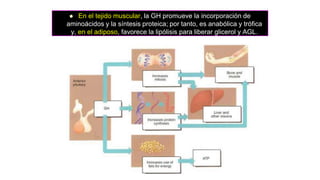
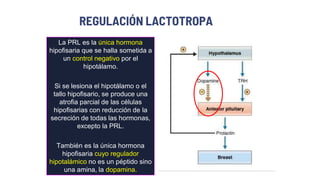
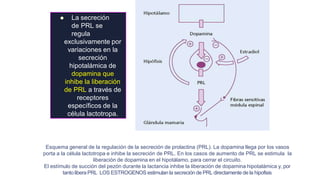
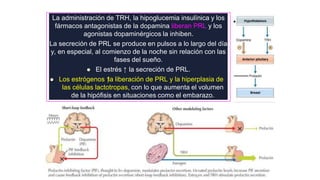
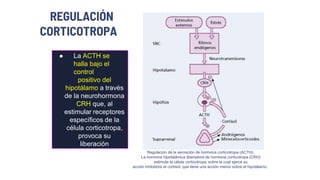
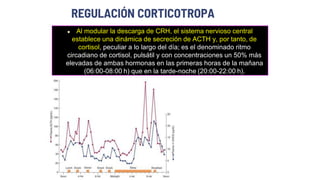
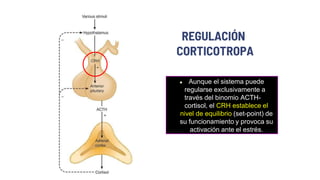
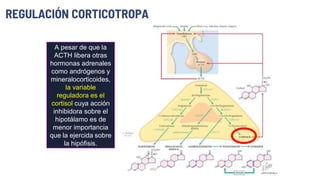
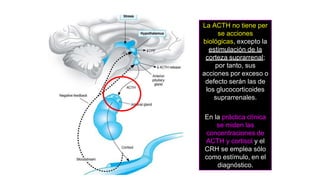
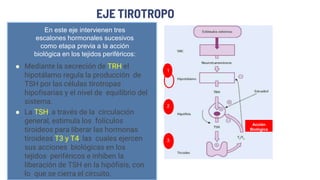
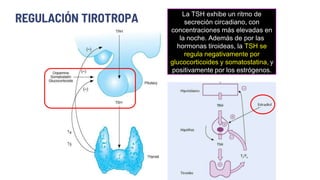
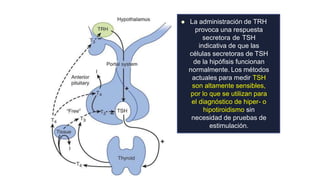
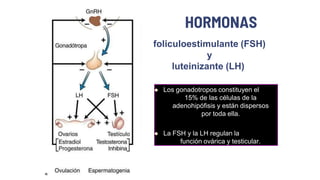
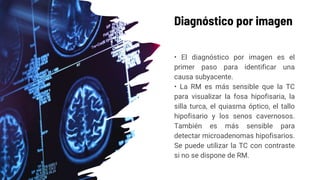
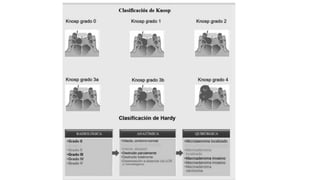
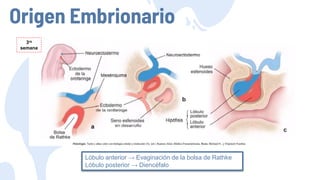
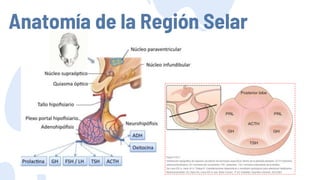
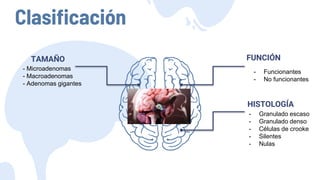
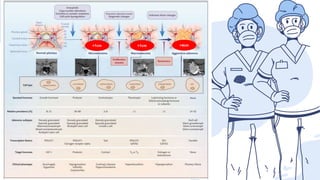
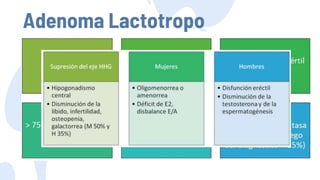
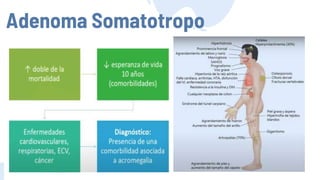
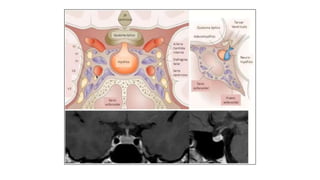
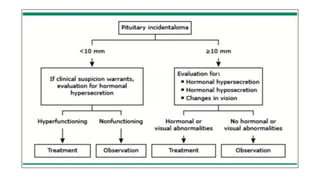
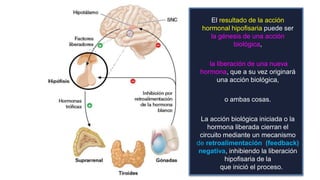
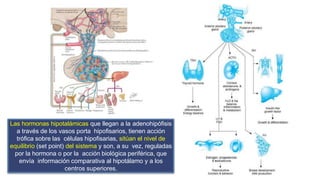
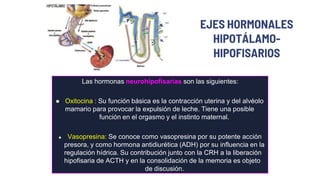
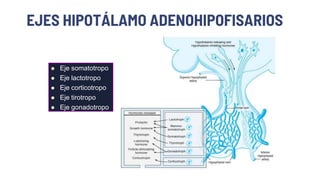
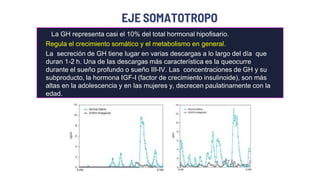
Este documento describe los adenomas hipofisarios, incluyendo su clasificación, epidemiología, tipos, manejo y los ejes hormonales que involucran a la hipófisis. Explica que los adenomas hipofisarios son neoplasias benignas del lóbulo anterior de la hipófisis que pueden causar síntomas por secreción hormonal excesiva o efecto de masa. Además, detalla los diferentes tipos de tratamiento disponibles como el médico o quirúrgico, dependiendo del tamaño y síntomas del tumor.




































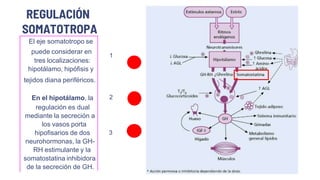
![La GH-RH abunda en los
tejidos intestinales, por lo que
no es útil determinar sus [ ]s
plasmáticas, salvo cuando se
sospeche la existencia de un
tumor ectópico.
La somatostatina inhibe tanto la
secreción basal de GH como la
provocada por cualquiera de los
estímulos conocidos, a través
de una acción directamente
hipofisaria, (sus análogos de
alta potencia se usan en el
diagnóstico y tratamiento de
tumores secretores de GH, TSH
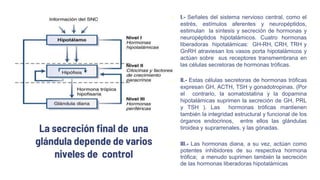
Schematic diagram of the hypothalamic control of growth hormone secretion.](https://image.slidesharecdn.com/adenomashipofisarios-231030094259-680ee19b/85/Adenomas-Hipofisarios-pptx-58-320.jpg)