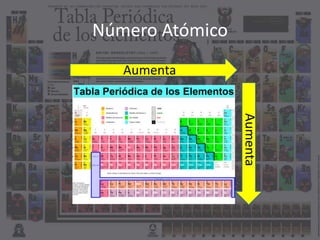
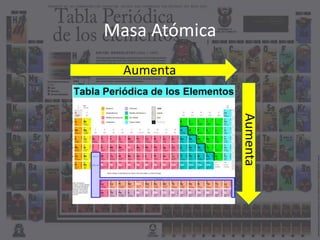
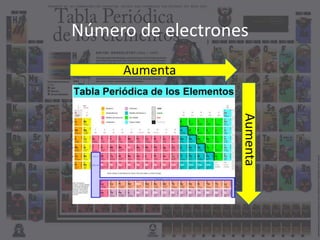
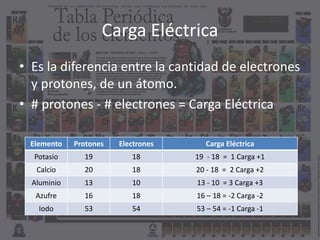
El documento describe las principales propiedades atómicas como el número atómico, la masa atómica, el número de electrones, protones y neutrones, y la carga eléctrica. Explica que el número atómico determina el elemento y es igual al número de protones, mientras que la masa atómica incluye protones y neutrones. La carga eléctrica depende de la diferencia entre protones y electrones.