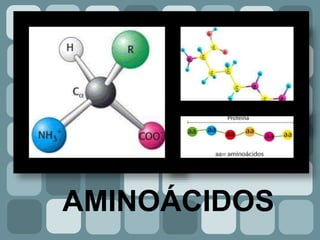
Los aminoácidos son compuestos orgánicos que contienen un grupo carboxilo, un grupo amino y un carbono alfa. Pueden ser sólidos, cristalinos y solubles en agua, y exhiben actividad óptica y comportamiento anfótero. Los aminoácidos se clasifican según el radical unido al carbono alfa y su requerimiento en el cuerpo, y se unen mediante enlaces peptídicos para formar proteínas y otras moléculas.