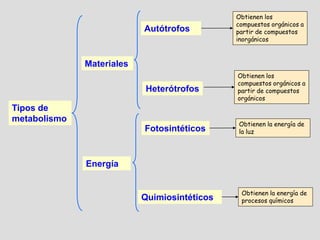
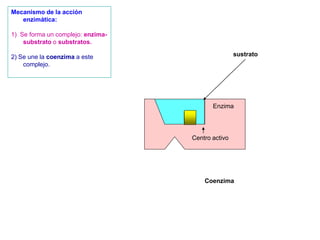
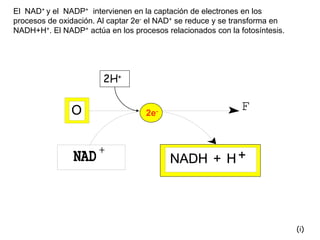
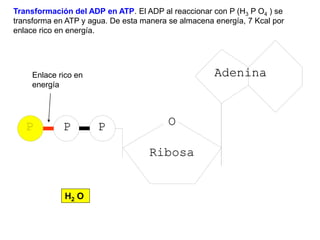
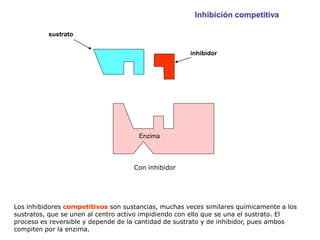
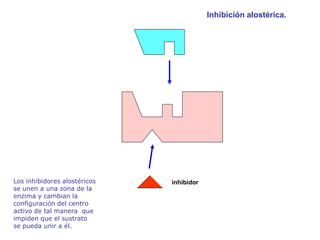
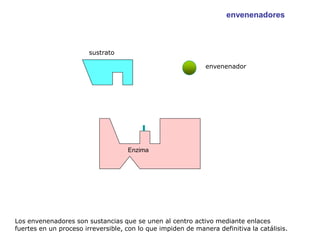
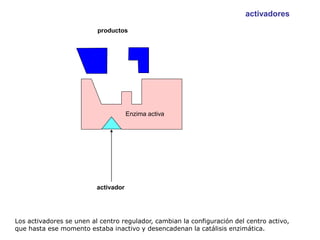
El documento describe los procesos metabólicos que ocurren en las células. Explica que el metabolismo consiste en reacciones químicas catalizadas por enzimas que obtienen materiales y energía para sustentar las funciones vitales. Describe dos tipos de vías metabólicas: el anabolismo, que construye sustancias complejas, y el catabolismo, que degrada moléculas. También explica los diferentes tipos de metabolismo basados en la fuente de materiales y energía.