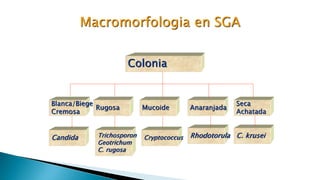
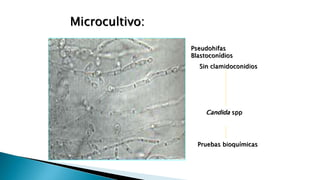
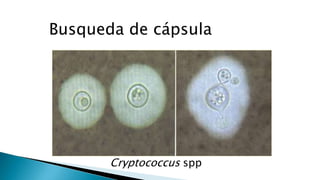
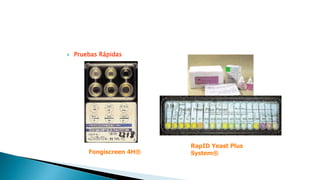
Este documento describe las características de las candidiasis, una infección micótica causada principalmente por especies del género Candida. Puede manifestarse de forma aguda, subaguda o crónica en diversos órganos y sistemas. Los principales agentes etiológicos son Candida albicans, C. glabrata, C. tropicalis y C. krusei. El diagnóstico requiere la identificación correcta de la especie de Candida a través de técnicas microbiológicas.