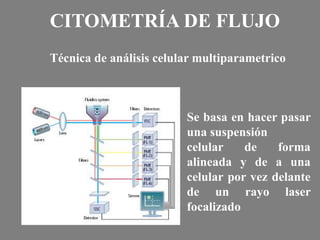
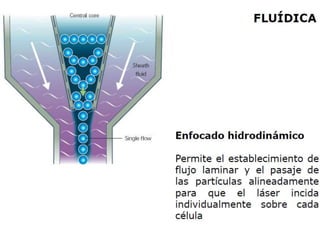
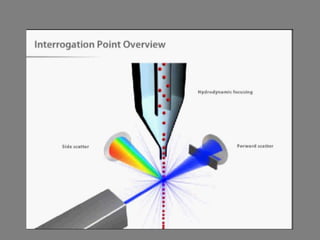
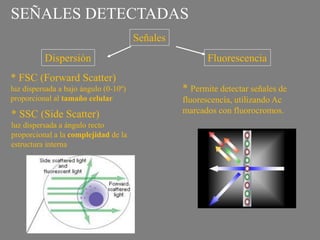
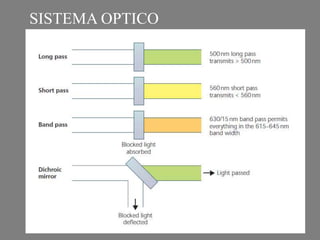
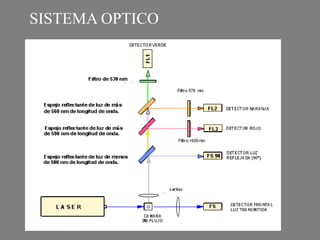
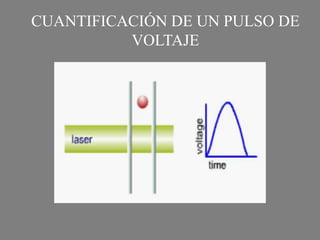
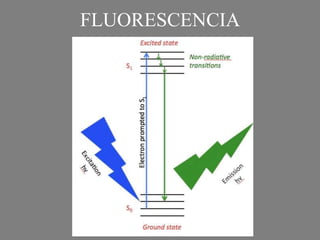
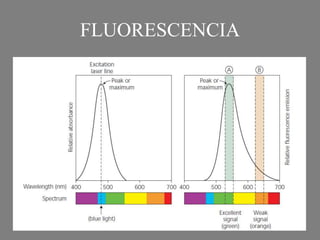
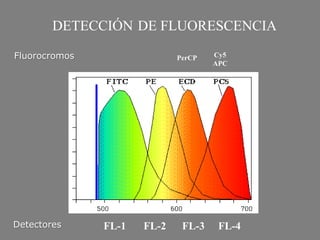
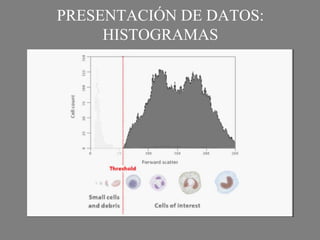
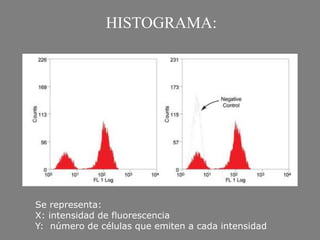
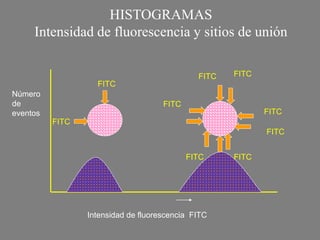
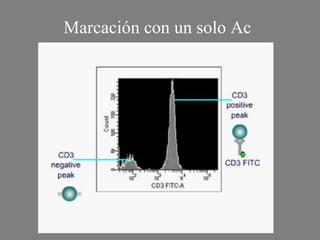
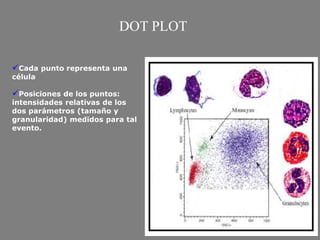
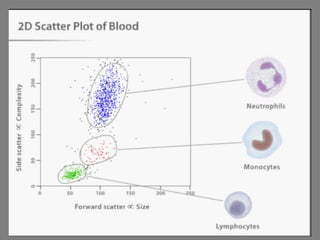
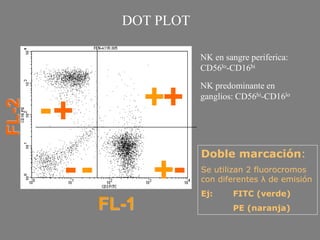
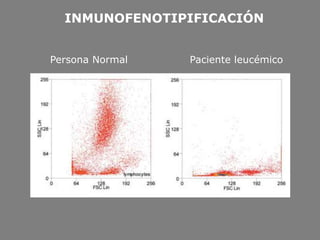
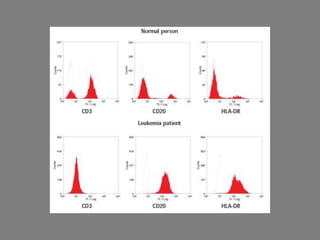
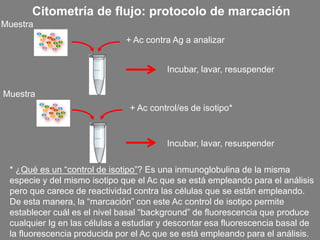
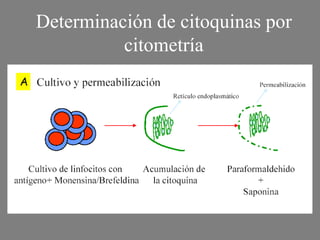
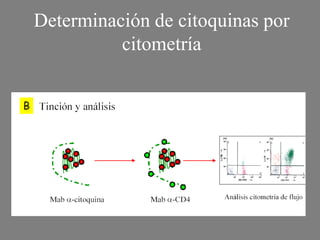
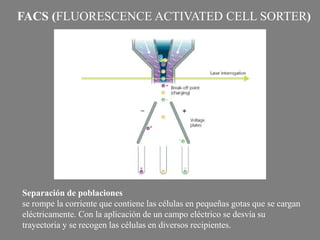
Este documento describe la citometría de flujo, una técnica de análisis celular multiparamétrico que permite detectar múltiples características de las células mediante el paso de una suspensión celular individual a través de un rayo láser. Incluye descripciones de los componentes ópticos, electrónicos y de fluidos del citómetro, así como de las señales que puede detectar como tamaño celular, complejidad interna y fluorescencia de marcadores. También resume aplicaciones como la inmunofenotipificación y