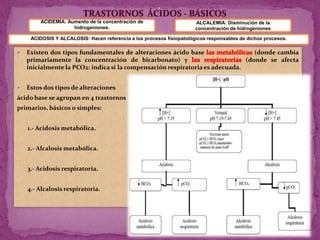
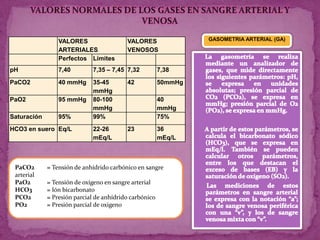
Este documento resume los conceptos clave relacionados con el equilibrio ácido-básico en el cuerpo humano. Explica los cuatro mecanismos principales que mantienen este equilibrio: los sistemas amortiguadores, el sistema pulmonar, los riñones y la sangre. También describe los cuatro tipos primarios de trastornos ácido-básicos y los factores que pueden influir en el pH.