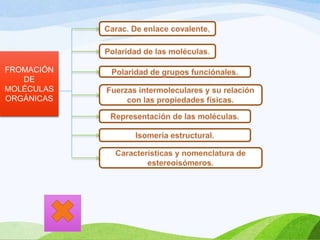
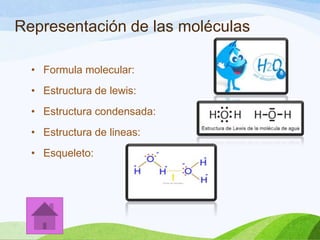
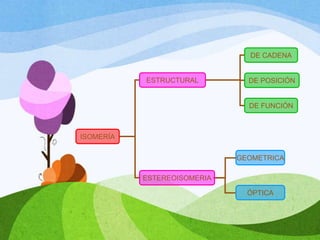
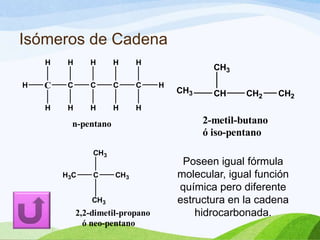
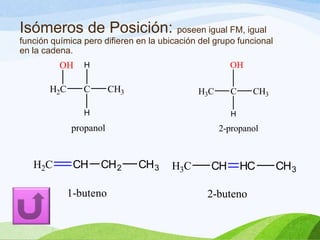
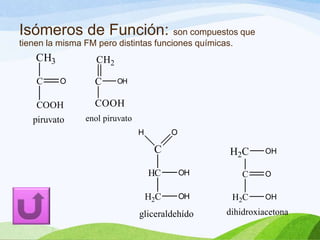
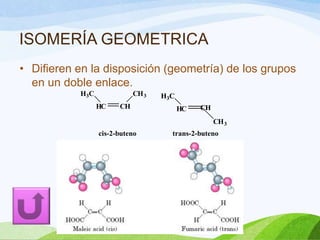
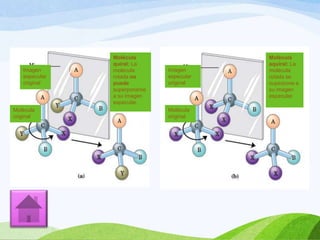
Las moléculas orgánicas se forman mediante enlaces covalentes entre átomos de carbono e hidrógeno, y otros elementos. Los enlaces pueden ser simples, dobles o triples. La polaridad de los enlaces y grupos funcionales determina las propiedades físicas de las moléculas. Existen diferentes tipos de isomería incluyendo isomería de cadena, posición y función, la cual ocurre cuando moléculas tienen la misma fórmula molecular pero diferentes estructuras o funciones.