El documento resume información sobre el virus de la hepatitis C (VHC), incluyendo su historia natural, manifestaciones hepáticas y extrahepáticas, y nuevos tratamientos antivirales. Resalta que aproximadamente 185 millones de personas están infectadas con VHC a nivel mundial y que la infección crónica puede conducir a cirrosis y cáncer hepático. Los nuevos tratamientos como los inhibidores de proteasa y sofosbuvir ofrecen altas tasas de curación sin interferón. El control de la infección por VHC puede reducir el riesgo de








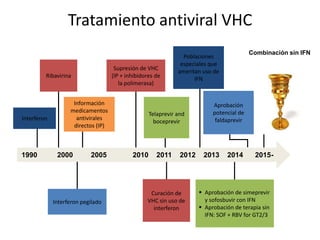

![Régimen de Telaprevir en pacientes vírgenes a
tratamiento, con genotipo 1 VHC
Incivek [package insert]. Cambridge, MA: Vertex; 2011.](https://image.slidesharecdn.com/hepatitisc-140429055328-phpapp01/85/HCV-causes-systemic-disorders-that-can-be-cured-11-320.jpg)

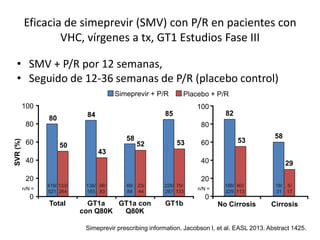


![Regímenes sin IFN, vírgenes a tx, GT1
1. Kowdley K, et al. EASL 2013. Abstract 3. 2. Lawitz E, et al. AASLD 2013. Abstract 215.
3. Everson GT, et al. AASLD 2013. Abstract LB-1. 4. Lawitz E, et al. AASLD 2013. Abstract 76.
AI443-014[3]:
Daclatasvir +
Asunaprevir +
BMS-791325
por 12 sem
77
100
80
60
40
20
0
100
96
89
25 27 13
MK-5172 + MK-8742 20 mg + RBV
MK-5172 + MK-8742 50 mg + RBV
MK-5172 + MK-8742 50 mg
C-WORTHY
12-semanas[4]:
100
80
60
40
20
0
92100
80
60
40
20
0
9595
100
20 21 19
SOF/LDV 8 sem
SOF/LDV + RBV 8 sem
SOF/LDV 12 sem
LONESTAR[2]:
Ledispasvir + Sofosbuvir
100
80
60
40
20
0
96
90
79 80
12 sem
AVIATOR[1]:
ABT-450/RTV + ABT-333
+ ABT-267 + RBV
SVR12/24(%)
24 sem
n =](https://image.slidesharecdn.com/hepatitisc-140429055328-phpapp01/85/HCV-causes-systemic-disorders-that-can-be-cured-17-320.jpg)