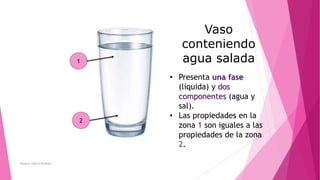
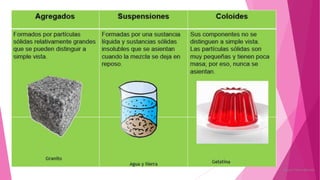
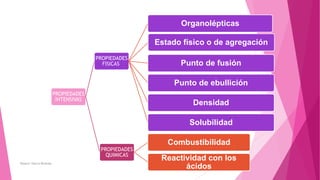
El documento describe los conceptos fundamentales de la química. Explica que la materia puede ser vista a nivel macroscópico y nanoscópico, y que a nivel nanoscópico está compuesta de átomos, moléculas o iones. También describe los diferentes tipos de sustancias como elementos, compuestos y mezclas, así como las propiedades y transformaciones que puede experimentar la materia.