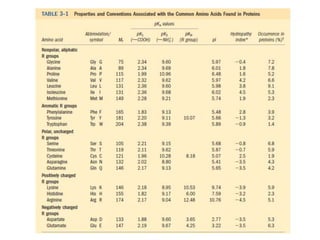
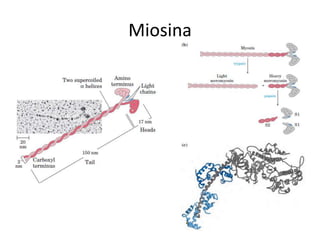
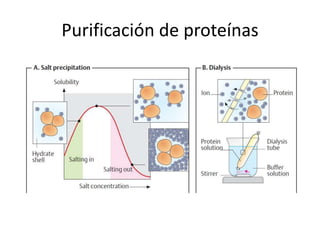
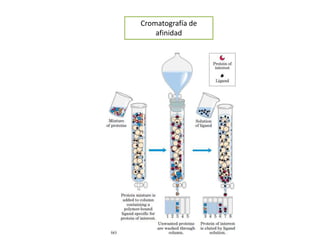
Las proteínas están formadas por cadenas de aminoácidos unidos por enlaces peptídicos. Tienen cuatro niveles de estructura: secuencia primaria de aminoácidos, estructuras secundarias como hélices alfa y láminas beta, plegamiento terciario tridimensional, y ensamblaje cuaternario de subunidades. Las proteínas se purifican usando métodos como cromatografía y electroforesis para separarlas basado en sus propiedades físicas y químicas.

















































![Péptidos y proteínas[1]](https://image.slidesharecdn.com/pptidosyprotenas1-110312120514-phpapp02/85/Peptidos-y-proteinas-1-54-320.jpg)