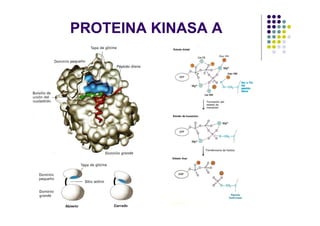
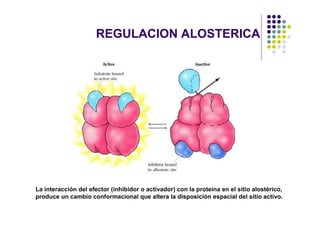
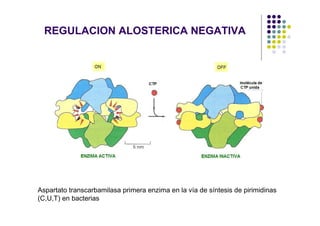
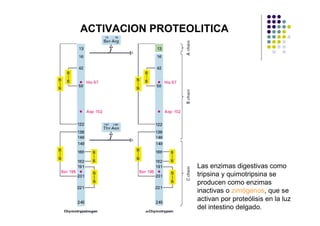
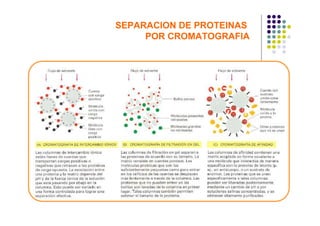
Las proteínas funcionan uniéndose selectivamente a moléculas llamadas ligandos. La especificidad de unión depende de enlaces no covalentes que forman entre los aminoácidos de la proteína y el ligando. Las enzimas aceleran las reacciones químicas al estabilizar los estados de transición mediante su sitio activo. La actividad de las proteínas se regula a través de mecanismos como la retroalimentación negativa, la regulación alostérica, la fosforilación y la hidrólisis de ATP. Las té