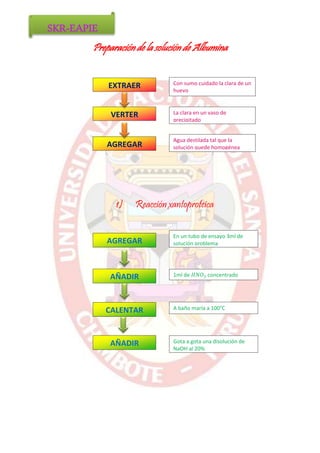
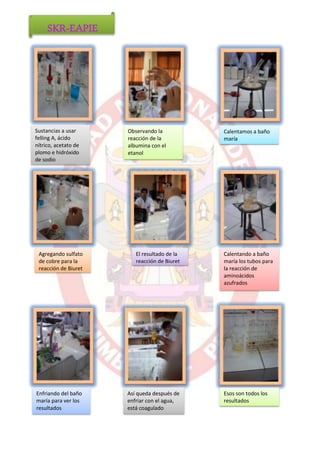
El documento describe los pasos para preparar una solución de albúmina y realizar diferentes pruebas para identificarla. Se extrae la clara de huevo y se agrega agua destilada para hacer una solución homogénea de albúmina. Luego se colocan muestras de esta solución en tubos de ensayo para realizar las reacciones de Biuret, aminoácidos azufrados y coagulación con diferentes sustancias como calor, etanol y ácidos.