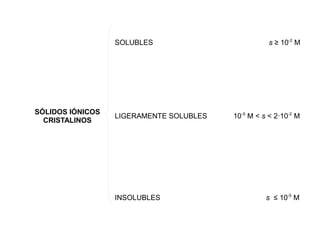
Este documento trata sobre los equilibrios de solubilidad. Explica conceptos como disolución saturada y solubilidad. También cubre factores que afectan la solubilidad como la temperatura, iones comunes y el pH. Define el producto de solubilidad y cómo determinar si ocurrirá precipitación al mezclar dos disoluciones iónicas.





![2. PRODUCTO DE SOLUBILIDAD
AgCl Ag+
(aq) + Cl-
(aq), KPS
= [Ag+
]·[Cl-
]
Bi2
S3
2 Bi3+
(aq) + 3 S2-
(aq), KPS
= [Bi3+
]2
·[S2-
]3
KPS
= (2s)2
·(3s)3
; s =
PRODUCTO DE
SOLUBILIDAD
5 KPS
108](https://image.slidesharecdn.com/tema7-170625145112/85/Tema-7-Equilibrio-de-solubilidad-7-320.jpg)
![Relación entre la solubilidad y KPS
AgCl Ag+
(aq) + Cl-
(aq)
[ ]o
-- –
[ ]eq
s s
KPS
= [Ag+
]eq
·[Cl-
]eq
= s2
; s = KPS](https://image.slidesharecdn.com/tema7-170625145112/85/Tema-7-Equilibrio-de-solubilidad-8-320.jpg)



![3. FACTORES QUE AFECTAN A LA SOLUBILIDAD
EFECTO DEL pH
Si el pH se hace más ácido (menor [OH-]): el equilibrio se
desplaza hacia la derecha aumentando la solubilidad.
Este efecto ocurre en todas las sales cuyo anión presente carácter
básico.
La solubilidad de las sales que contienen aniones básicos
aumenta conforme el pH disminuye.
Mg(OH)2
Mg2+
(aq) + 2 OH-
(aq)
CaF2
Ca2+
(aq) + 2 F-
(aq)
F-
(aq) + H2
O (l) HF (aq) + OH-
(aq)](https://image.slidesharecdn.com/tema7-170625145112/85/Tema-7-Equilibrio-de-solubilidad-12-320.jpg)