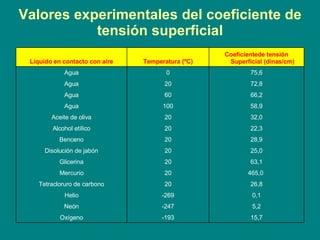
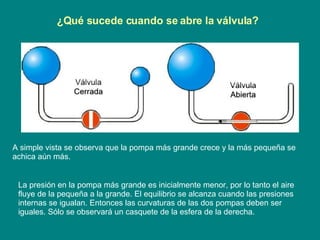
El documento trata sobre la tensión superficial y sus aplicaciones. Explica conceptos como fuerza superficial, coeficiente de tensión superficial, ángulo de contacto, ley de Laplace, y el papel de los tensioactivos. Describe cómo la tensión superficial causa que los líquidos adopten formas esféricas y cómo afecta fenómenos como la capilaridad y la formación de burbujas y pompas de jabón.