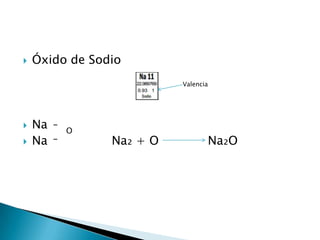
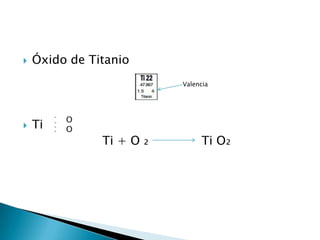
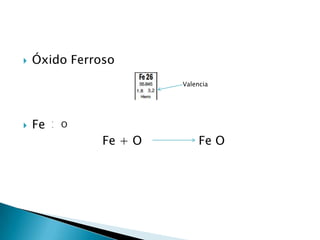
Un óxido es un compuesto binario formado por uno o más átomos de oxígeno y otro elemento. Los óxidos existen en los tres estados de agregación principales y la mayoría de los elementos forman óxidos estables con oxígeno en diferentes estados de oxidación, lo que da como resultado una gran variedad de propiedades.