Seguimiento presentación enzimas
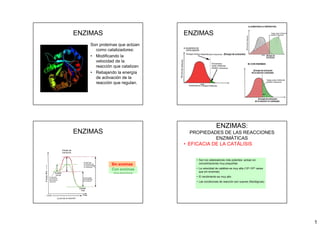
- 1. 1 ENZIMAS Son proteínas que actúan como catalizadores: • Modificando la velocidad de la reacción que catalizan • Rebajando la energía de activación de la reacción que regulan. ENZIMAS B) CON ENZIMAS ENZIMAS Con enzimas (línea discontinua) Sin enzimas ENZIMAS: PROPIEDADES DE LAS REACCIONES ENZIMÁTICAS • EFICACIA DE LA CATÁLISIS • Son los catalizadores más potentes: actúan en concentraciones muy pequeñas • La velocidad de catálisis es muy alta (108-1020 veces que sin enzimas) • El rendimiento es muy alto • Las condiciones de reacción son suaves (fisiológicas)
- 2. 2 ENZIMAS: PROPIEDADES DE LAS REACCIONES ENZIMÁTICAS • EFICACIA DE LA CATÁLISIS • ESPECIFICIDAD Puede ser: • Absoluta o de sustrato. (v.g. ureasa) • Relativa o de reacción • Estereospecificidad (v.g. D-aminooxidasas) • De grupo (v.g. hexoquinasas) • De clase (v.g. estearasas) ENZIMAS: PROPIEDADES DE LAS REACCIONES ENZIMÁTICAS • EFICACIA DE LA CATÁLISIS • ESPECIFICIDAD • REGULACIÓN • REVERSIBILIDAD • Mediante la cantidad de enzima, regulando la expresión génica (transcripción) • Mediante el control de la actividad enzimática Mecanismos de irreversibilidad: - Salto energético grande - Compartimentación celular de algún paso, lo que separa enzima y sustrato • Nomenclatura histórica: – SUSTRATO + ACTIVIDAD + SUFIJO(asa) (v.g. glucoquinasa) – SUSTRATO + SUFIJO(asa) (v.g. ureasa) – DONADOR + ACEPTOR + ACTIVIDAD + SUFIJO(asa) (v.g. oxalacetilaminotransferasa) • Nomenclatura IUB (1972): 6 grupos según la reacción catalizada ENZIMAS Nomenclatura 1. OXIDORREDUCTASAS ENZIMAS Nomenclatura Sin transferencia de hidrógenos • Regulan reacciones REDOX • Existen dos tipos esenciales: • Con transferencia de hidrógenos • Sin transferencia de hidrógenos Con transferencia de hidrógenos
- 3. 3 ENZIMAS Nomenclatura 2. TRANSFERASAS • Transfieren grupos funcionales 3. HIDROLASAS ENZIMAS Nomenclatura •Rotura de enlaces por medio de agua 4. LIASAS ENZIMAS Nomenclatura •Rotura o formación de moléculas sin intervención de agua. •Suele producirse adición a dobles enlaces: C=C, C=O, C=N 5. ISOMERASAS ENZIMAS Nomenclatura Cambio de posición de grupos dentro de la molécula
- 4. 4 6. LIGASAS O SINTETASAS ENZIMAS Nomenclatura Formación de enlaces con rotura de ATP Transformación del complejo E-S en E-P (enzima-productos) Formación del complejo enzima- sustrato Liberación de los productos y de la enzima ENZIMAS Mecanismo de actuación ENZIMAS Cinética enzimática • Es la concentración de sustrato a la que la velocidad de reacción es la mitad de la velocidad máxima. • Es una medida de la afinidad de la enzima por el sustrato: KM alta AFINIDAD baja
- 5. 5 ENZIMAS Cinética enzimática ¿Cómo calcular la velocidad máxima? La velocidad enzimática aumenta con la T hasta un valor crítico en el que la proteína se inactiva por desnaturalización ENZIMAS Factores que influyen en la actividad enzimática • Moduladores ambientales – pH Cada enzima tiene su pH óptimo de actuación Temperatura – σ La concentración salina puede llegar a precipitar una proteína e inactivarla ENZIMAS Factores que influyen en la actividad enzimática • Moduladores ambientales • Cocatalizadores Algunas enzimas requieren la presencia de una molécula no proteica para la catálisis: son las proteínas CONJUGADAS u HOLOENZIMAS APOENZIMA: parte proteica Según la complejidad de la porción no proteica: • Cofactor • Coenzima • Grupo prostético ENZIMAS Factores que influyen en la actividad enzimática • Moduladores ambientales • Cocatalizadores • Activadores e Inhibidores – REGULACIÓN ALOSTÉRICA La unión no covalente de una molécula a la enzima, en un sitio diferente del centro activo (sitio alostérico) provoca un cambio conformacional que modifica la afinidad de la enzima por el sustrato. El regulador alostérico puede ser activador o inhibidor
- 6. 6 ENZIMAS Factores que influyen en la actividad enzimática • Moduladores ambientales • Cocatalizadores • Activadores e Inhibidores – REGULACIÓN ALOSTÉRICA Las enzimas alostéricas son grandes, oligoméricas y su cinética no se ajusta a la curva de Michaelis- Menten, por presentar cooperativismo: La unión del sustrato a un centro activo favorece la unión de más sustratos a los demás centros activos de las demás subunidades. ENZIMAS Factores que influyen en la actividad enzimática • Moduladores ambientales • Cocatalizadores • Activadores e Inhibidores – REGULACIÓN ALOSTÉRICA TIPOS ENZIMAS Factores que influyen en la actividad enzimática • Moduladores ambientales • Cocatalizadores • Activadores e Inhibidores – REGULACIÓN NO ALOSTÉRICA (ISOSTÉRICA) • El inhibidor o activador actúa sobre el centro activo. • La enzima muestra una cinética de Michaelis-Menten, aunque alterada respecto de la gráfica normal. • Puede ser: • IRREVERSIBLE: si el enzima queda modificado covalentemente, alterando su estructura terciaria. Su reversión requiere la acción enzimática. • REVERSIBLE: La inactivación no es permanente. ENZIMAS Factores que influyen en la actividad enzimática • INHIBICIÓN REVERSIBLE – La inactivación no es permanente. – Según su modo de actuación puede ser: • Competitiva: se unen al centro activo del enzima • Acompetitiva: se une al complejo E-S • No competitiva: puede unirse a ambos E + S E-S E-P Ic Iac Inc
- 7. 7 ENZIMAS Factores que influyen en la actividad enzimática • INHIBICIÓN REVERSIBLE: CINÉTICA DE LA INHIBICIÓN = In c = Ia c =Ic KM aparente PendienteVmaxTipo ENZIMAS Factores que influyen en la actividad enzimática • INHIBICIÓN MIXTA: SUSTRATOS SUICIDAS E + I EI EI* E’ + I* 1 2 3 1. El inhibidor se fija a la enzima 2. La acción catalítica de la enzima convierte al inhibidor I en una especie altamente reactiva I* 3. I* modifica covalentemente a la enzima, inactivándola de forma definitiva al igual que un inhibidor irreversible. • Es un modo de regulación que consiste en la existencia de distintas formas moleculares de una misma enzima que presentan o muestran especificidad por el mismo sustrato y realizan la misma función. • Su distribución varía con los tejidos y la localización subcelular, de forma que unas se encuentran en el citoplasma, otras en las mitocondrias, algunas en cloroplastos, etc. • Se diferencian entre sí por su composición de aminoácidos, al estar codificadas por genes distintos (con un origen evolutivo común, por duplicación génica) ENZIMAS Isoenzimas • La lactato deshidrogenasa cataliza la transformación de pirúvico a láctico, que se produce en condiciones de anoxia, dando lugar a una fermentación a partir de la glucosa. ENZIMAS Isoenzimas
- 8. 8 • Estas isoenzimas presentan carácterísticas cinéticas distintas. Está formada por 5 isoenzimas, con el mismo peso molecular, con una estructura tetramérica: combinaciones de 2 tipos de cadenas, M y H. ENZIMAS Isoenzimas V máx pequeña Especializado en el uso aeróbico del pirúvico. Sólo se emplea la ruta anaeróbica en emergencias. KM piruvato alta (afinidad baja)H4 V máx alta Tejido especializado en el uso anaeróbico de la glucosa con alta formación de lactato KM piruvato baja (afinidad alta)M4 LDH-1 (H4): en corazón, músculos y eritrocitos. LDH-2 (H3M): en sistema retículoendotelial y leucocitos. LDH-3 (H2M2): en pulmones. LDH-4 (HM3): en riñones, placenta y páncreas. LDH-5 (M4): en hígado y músculo esquelético. ENZIMAS Sistemas multienzimáticos • Son asociaciones de enzimas que realizan funciones complementarias, actuando de modo secuencial, catalizando reacciones consecutivas: el producto de una reacción es el sustrato de la siguiente. • La eficacia de la reacción aumenta, al favorecer el encuentro del enzima y el sustrato. • Existen dos niveles de asociación: – Complejos multienzimáticos: existe unión covalente entre las enzimas. Generalmente estas enzimas no funcionan fuera del complejo. Ej: sintetasa de ácidos grasos de levadura (7 enzimas) – Asociación a membranas. Ej: cadena respiratoria en la membrana mitocondrial interna.
