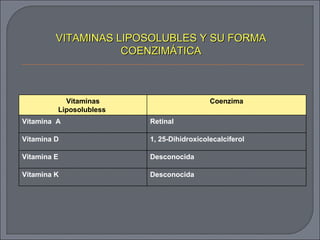
El documento describe los biocatalizadores de naturaleza proteica conocidos como enzimas. Las enzimas son catalizadores orgánicos que aceleran las reacciones químicas sin consumirse en el proceso. Actúan a través de su sitio activo donde se une el sustrato y catalizan la reacción. Existen diferentes clases de enzimas según la reacción que catalizan como oxidorreductasas, transferasas e hidrolasas. Su actividad depende de factores como la concentración de sustrato, temperatura y pH






















![REPRESENTACIÓN DE LINEWEAVER-BURK Representación doble recíproca (1/v frente a 1/[S]: línea recta. Pendiente es K M /V max Origen de la abscisa es -1/K M Origen de la ordenada es 1/V max](https://image.slidesharecdn.com/enzimas-111104143545-phpapp01/85/Enzimologia-23-320.jpg)

![Baja [S]: velocidad inicial directamente proporcional a la concentración de sustrato ( reacción de primer orden). Alta [S]: enzima saturada por el sustrato, y la velocidad ya no depende de [S]. Se alcanza la velocidad es máxima (V max ).](https://image.slidesharecdn.com/enzimas-111104143545-phpapp01/85/Enzimologia-25-320.jpg)