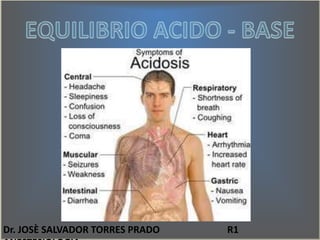
El documento describe el equilibrio ácido-base en el cuerpo. Explica que el pH sanguíneo normal es de 7.35-7.45 y que esto se mantiene a través de los sistemas respiratorio, renal y tampón. También define conceptos como acidosis metabólica, acidosis respiratoria y los mecanismos de regulación para contrarrestar cambios en el pH.





![PH
• pH=- log [H+]
• pH normal: 7.35-7.45
• pH﹤7.35 → acidosis oacidemia
pH﹥7.45 → alcalosisoalcalemia
• Un valor normal del pH puederepresentar un
trastornoacido-base
Bibliografia : Tratado de fisiologia medica decimaedicion, guyton- hall, mcgraw, hill
texto de anestesiologiateorico– practica 2da edicionj.antonioAldrete , manual moderno](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-7-320.jpg)
![2. PaCO2(presión parcial del CO2 en sangre arterial)
• PaCO2está en equilibrio con el H2CO3
• PaCO2 escontroladopor la respiración
– hipoventilatión→↑ PaCO2
– hiperventilatión→↓ PaCO2
• PaCO2 : 35~45mmHg, promedio: 40mmHg.
[CO2]dissolved+H2O H2CO3
pH = pKα+ lg
[HCO3
-]
[H2CO3]
= pKα + lg
[HCO3
-]
α· PaCO2
PARAMETRO RESPIRATORIO
Bibliografia : Tratado de fisiologia medica decimaedicion, guyton- hall, mcgraw, hill
texto de anestesiologiateorico– practica 2da edicionj.antonioAldrete , manual moderno](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-8-320.jpg)
![3. [HCO3
-]
• [HCO3
-]: refleja la cargaácido-base:
– ↑H+ → HCO3
- aumentaparaneutralizar H+
– ↑OH- → HCO3
- incrementa: H2CO3 + OH- HCO3
-+H2O
• [HCO3
-] refleja la función renal tubular
(regeneraciónoreclamo del HCO3
- ). Reabsorción renal del
HCO3
-escontroladapor el pH
• [HCO3
-]: 22-27mmol/L, promedio: 24mmol/L
PARAMETRO METABOLICO
Bibliografia : Tratado de fisiologia medica decimaedicion, guyton- hall, mcgraw, hill
texto de anestesiologiateorico– practica 2da edicionj.antonioAldrete , manual moderno](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-9-320.jpg)
![4. HiatoAniónico (HA) o anion gap
• HA= aniones no medibles – cationes no medibles
• HA=[Na+] - ([Cl-] + [HCO3
-])
• Normal AG es 8 a 16 mmol/L
• ↑HA
– ↑aniones
• Fosfatos, sulfatos, acidosorgánicosyaniones de
proteinas
– Sugiere acidosis metabólica
• ↓HA
– ↓aniones
• Hipoalbuminemia
– ↑cationes
• Hiperpotasemia, hipercalcemia, etc
CNBibliografia : Tratado de fisiologia medica decimaedicion, guyton- hall, mcgraw, hill
texto de anestesiologiateorico– practica 2da edicionj.antonioAldrete , manual moderno](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-10-320.jpg)






![2. Regulación respiratoria
• El pulmónregula la relación de [HCO3
-]/[H2CO3]
paraalcanzar :20(hco3)/1(co2) ycontrolar la
ventilación alveolaryeliminar el CO2: mantiene el
valor del pH.
pH = pKα+ lg
[HCO3
-]
[H2CO3]
= pKα + lg
[HCO3
-]
α· PaCO2](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-17-320.jpg)
![Regulación de ventilación alveolar
• Control por centro respiratorio
• Estímulos:
– Centrales (medulla oblongata)
• [H+] en el LCR
– ↑*H++ → → ↑VA
• PaCO2
– > 60mmHg→ VA incrementa 10 veces
– > 80mmHg→ centro respiratorio inhibido
– Periféricos (cuerpo carotideo y aortico)
• ↓PaO2 or ↑PaCO2 or ↑*H+]
– ↓PaO2< 60mmHg→ → ↑VA
– ↓PaO2< 30mmHg→ centro respiratorio inhibido](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-18-320.jpg)
![3. Regulación renal
• El riñón regula el [HCO3
-] : excreción de ácidos y la
conservación de bicarbonato, para alcanzar una
relación de [HCO3
-]/[H2CO3] :20/1
pH = pKα+ lg
[HCO3
-]
[H2CO3]
= pKα + lg
[HCO3
-]
α· PaCO2](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-19-320.jpg)



![ACIDOSIS METABLICA
Causasprimarias
• Cambio : ↓ *HCO3
-]
– Pérdidadirectaexcesiva del HCO3
- :
(ej DIARREAS, Y FISTULAS OJO: “PERO NO VOMITOS”
puesestoscausarianalcalosismetabolicaporperdida ac.
clorhidrico)
– Pérdidaindirecta de HCO3
- :
• Exceso de ingesta de ácidos ( ej ASA, metanol)
• Exceso de producción de ácidos no volátiles
• Disminución de la excreción renal de ácidos](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-23-320.jpg)










![• Regulación renal
– Principal método compensatorio de acidosis respiratoria
crónica
– Proceso
• ↑ PaCO2 y [H++ = ↑ actividad de anhidrasa carbónica y
glutaminasa en celulas tubulares renales →secreción tubular de H+
y amonio y reabsorción de HCO3
-
– [HCO3
-] puede incrementar 3.5-4.5mmol/L por cada
10mmHg de incremento de PaCO2.
– Acidosis respiratoria crónica es usualmente compensada](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-34-320.jpg)


![• Regulaciónrespiratoria
– ↓*H++ →inhibecentrorespiratorio →↓ventilación
alveolar→ ↑PaCO2o [H2CO3+ → *HCO3
-]/ [H2CO3]
alcance: 20/1
– eslimitada
• Límitecompensatorio del incrementosecundario de la
PaCO2 es55mmHg OJO IMPORTANTE POR LA
INHIBICION DE CENTRO RESPIRATORIO POR ARRIBA DE
55MMHG EJ: CUANDO SE DEJA CO2 PARA ESTIMULAR
CENTRO RESPIRATORIO.](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-37-320.jpg)



![• Regulación renal
– Principal métodocompensatorio de
alcalosisrespiratorio
– Procesodetallado
• Disminución de la actividad de
anhidrasacarbónicayglutaminasa en
lascélulastubularesrenales→secreción de
H+yamonioyreabsorción de HCO3
-
→↑excreción renal de HCO3
-
– [HCO3
-] puededisminuir 5mmol/L porcada
10mmHg de disminución de PaCO2.
– Procesoscrónicos son usualmentecompensados](https://image.slidesharecdn.com/equilibrioacidobase-130624093334-phpapp01/85/Equilibrio-acido-base-41-320.jpg)






