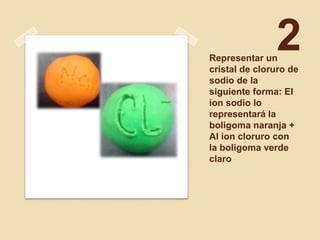
El resumen describe la construcción de la solvatación del cloruro de sodio usando plastilina y palillos. Se representa un cristal de cloruro de sodio usando boligomas naranjas para el ión sodio y verdes claras para el ión cloruro. Luego, se representa la solvatación colocando 12 moléculas de agua formadas por palillos y boligomas amarillas y verdes alrededor de los iones para separarlos.


![Marco teórico
Las sales se pueden clasificar en los siguientes grupos:[1]
Sal haloidea, hidrácida o binaria neutra: son compuestos binarios formados
por un metal y un no-metal, sin ningún otro elemento. El anión siempre va a
tener la terminacion -uro. Ejemplos: cloruro de sodio, NaCl; cloruro de hierro
(III), FeCl3; sulfuro de hierro (II), FeS. Sal de oxácido: procede de sustituir los
hidrógenos de un oxácido por cationes metálicos.
Sal oxácida, oxiácida o ternaria neutra: se sustituyen todos los
hidrógenos. Ejemplo: hipoclorito de sodio, NaClO.
Sal ácida: se sustituyen parte de los hidrógenos. Ejemplo:
hidrogenocarbonato de sodio o bicarbonato de sodio, NaHCO3.
Sal básica o hidroxisal: contienen iones hidróxido (OH-), además de
otros aniones. Se pueden clasificar como sales o hidróxidos. Ejemplo:
hidroxicarbonato de hierro (III), Fe(OH)CO3.
Sal doble: se sustituyen los hidrógenos por dos o más cationes.
Ejemplo: carbonato doble de potasio y litio, KLiCO3.](https://image.slidesharecdn.com/actividadexperimentaldesolvatacion-130310215232-phpapp02/85/Actividad-experimental-de-solvatacion-3-320.jpg)